Apartados
Resumen
Abstract
Introducción
Material y métodos
Resultados
Discusión
Conclusión
Referencias
López-Hernández Mercedes Nicté1, López-Hernández Erandi de la Luz2, Wilson-Manríquez Eduardo Antonio3, Torres-Huerta Juan Carlos1. 1Centro Médico Nacional 20 de noviembre ISSSTE, CDMX. 2Hospital Ángeles del Pedregal, CDMX. 3Instituto Nacional de Neurología y Neurocirugía “Manuel Velasco Suárez”, CDMX.
Anestesia en México 2025;37(2): 121-141 https://doi.org/10.64221/aem-37-2-2025-009
Fecha de recepción octubre 2024, fecha de revisión enero 2025, fecha de publicación marzo 2025. wilson61723@gmail.com
Palabras Clave: Neuralgia Trigeminal, Tratamiento, DMV
Abstract
Introduction: Trigeminal neuralgia (NT) is an entity of facial pain attributed to a lesion or disease of the trigeminal nerve, affecting at least one branch, and is characterized by brief attacks of pain described as acute, cutting, lacerating or electric shock. The scope of this review is to provide a synthesis of all the clinical studies in English or Spanish from 2018 of treatment of NT. Methods: A systematic review was done according to the Cochrane guidelines. Our search found a total of 582 studies of which a total of 71 were included in the final review. Results: In the reviewed studies different pharmacological, surgical, ablative, and other treatment modalities were compared. The rate of cure was 45 to 90 % depending on the treatment modality that was used. Microvascular decompression surgery had the highest cure rate with less recurrence, other ablative procedures that were comparable were percutaneous balloon compression and radiofrequency ablation. The most common adverse effect was facial numbness, facial paralysis, and masseter muscle weakness. The recurrence rate was low with microvascular decompression. Conclusions: Microvascular decompression is still the gold standard of treatment, other percutaneous procedures have acceptable rate of disease remission with a good level of evidence, especially percutaneous balloon compression and radiofrequency thermocoagulation. Other methods (central lateral thalamotomy, ozone injection, peripheral nerve neurostimulation, etc.) are still being studied and more studies with better evidence grades are necessary.
Palabras Clave: Trigeminal Neuralgia, Treatment, Microvascular Decompression.
Introducción
A lo largo de la historia la NT ha sido una enfermedad caracterizada por su difícil control, sobre todo antes de la medicina actual. Se describe desde por lo menos 400 A.C., incluso por el mismo Hipócrates. Hasta finales del siglo XIX se inicia con cirugías (o por lo menos intentos de esta) como tratamiento de la patología, con algunos casos exitosos, aunque de forma transitoria con recurrencia de dolor, así como complicaciones a corto y largo plazo. Actualmente existen múltiples métodos de tratamiento de esta patología, algunos factores a tomar en cuenta para elección del tratamiento será edad del paciente, comorbilidades, tiempo de evolución, etiología de su NT y opciones disponibles en el momento de tomar decisión del tratamiento. Cada tipo de tratamiento tendrá algunas especificaciones, desenlace dependiendo de la condición clínica y efectos adversos que se deberá de tomar en consideración por un equipo multidisciplinario. Por tal motivo, la presente revisión sistemática examinó la literatura en distintas bases de datos en el período de 2018 a 2023, con el objetivo de integrar la información actual y contribuir con la literatura para conocer las técnicas para el manejo de dolor actuales en pacientes con NT.
La NT es un cuadro de dolor facial atribuible a una lesión o enfermedad del nervio trigémino, afectando por lo menos una rama, y es caracterizada por ataques breves de dolor descritos como agudo, cortante, lacerante o de choque eléctrico. (1) La prevalencia estimada es de 0.16-0.3 %, mientras que la incidencia anual es de 4-19 por cada 100,000 personas-años. Es más prevalente en mujeres que hombres (tasa 3:2). Incidencia aumenta con edad, edad media de inicio 53-57 años y rango de años 24-93 años. (2)
El nervio trigémino es de función mixta, aunque las fibras sensitivas son claramente las predominantes. Los núcleos se extienden por todo el tronco encefálico, desde el mesencéfalo hasta los primeros segmentos de la columna cervical. El núcleo motor y el núcleo sensorial principal están situados en la protuberancia media, y el núcleo espinal, que recibe información sobre el dolor y la temperatura, se extiende desde la protuberancia a la médula espinal superior. La raíz sensorial más grande, formando el ganglio de Gasser, contiene los somas de neuronas sensoriales. El componente sensorial tiene 3 divisiones: la oftálmica (V1), maxilar (V2) y ramas mandibulares (V3). (3) Las fibras se clasifican en nociceptivas (fibras Aδ y C) y fibras mecanorreceptoras de bajo umbral (fibras Aα y Aβ). Las fibras C son pequeñas fibras amielínicas con una velocidad de conducción lenta, mientras que las fibras Aδ son finamente mielinizadas, de tamaño mediano y presentan una mayor velocidad de conducción. Ambos tipos pueden ser estimulado por mecanismos mecánicos, térmicos o químicos. Las fibras propioceptivas Aα y Aβ son más grandes, mielinizadas, fibras con conducción rápida, y son estimuladas por indoloro o estímulos propioceptivos. (4)
La NT clásica probablemente se deban a compresión de la raíz nerviosa por un vaso sanguíneo tortuoso (58-75 % de estos casos), el vaso involucrado es la arteria cerebelosa superior, (5) compresión venosa se presenta en 10 % de los casos. Aun así, hasta el 30 % de los pacientes sometidos a DMV no presentan mejoría después de realizarse la intervención quirúrgica. (6) La NT secundaria presenta con paroxismos recurrentes de dolor unilateral consistente con criterios diagnósticos de NT con una enfermedad subyacente como causa (la más común siendo tumores). Existe también la subclasificación de dolor continuo concomitante entre paroxismos de dolor, así como una neuropatía trigeminal dolorosa (solamente afectada una raíz nerviosa). (7)
Debido a una etiopatogenia variada y un mecanismo fisiopatológico incierto y multifactorial, la presentación clínica puede ser variable. Existen líneas de tratamiento bien establecidos, sin embargo, muchos casos pueden ser refractarios y/o recurrentes posteriores a alcanzar un tratamiento supuestamente exitoso. El tratamiento de esta patología sigue en evolución, existe nueva evidencia y nuevas recomendaciones para buscar la resolución de dolor en estos pacientes. Actualmente existen múltiples métodos de tratamiento de esta patología, algunos factores a tomar en cuenta para elección del tratamiento será edad del paciente, comorbilidades, tiempo de evolución, etiología de su NT y opciones disponibles en el momento de tomar decisión del tratamiento. Cada tipo de tratamiento tendrá algunas especificaciones, desenlace dependiendo de la condición clínica y efectos adversos que se deberá de tomar en consideración por un equipo multidisciplinario. Por tal motivo, la presente revisión sistemática examinó la literatura en distintas bases de datos en el período de 2018 a 2023, con el objetivo de integrar la información actual y contribuir con la literatura para conocer las técnicas para el manejo de dolor actuales en pacientes con NT.
La NT es un cuadro de dolor facial breve caracterizado por dolor tipo choque eléctrico limitado a distribución de uno o más divisiones del nervio trigémino, el dolor suele ser evocado por estímulos triviales como lavar de dientes, hablar, masticar, entre otros. La prevalencia estimada durante la vida es de 0.3 %, con incidencia anual de 12.6 por cada 100,000 personas-año. La edad mediana de presentación es 53.9 años. (8,9)
La etiología en la mayoría de los casos es una lesión del nervio trigémino en la entrada nerviosa en puente o tracto nervioso. Numerosas alteraciones del nervio trigémino se han descrito, tales como compresión secundaria por estructuras vasculares, desmielinización focal, atrofia axonal o daño a células de Schwann/oligodendrocitos. (10)
Según la teoría de Devor et al, (11) existe desmielinización focal en la zona de entrada de raíz en el puente, en esta zona la mielina central cambia a periférica y es particularmente susceptible a daño secundario por compresión extrínseca. La compresión del nervio local en la zona de transición incluye desmielinización focal de fibras propioceptivas, las cuales hacen contacto y sinapsis con fibras nociceptivas no mielinizados, este contacto causa transmisión inadecuada de potenciales de acción entre fibras e inicio de ataques con estimulación táctil de la cara. (12, 13)
La NT sigue siendo un diagnóstico clínico dependiente de un interrogatorio detallado y referencia del paciente de un dolor súbito e intenso de tipo lacerante o cortante que se presenta como sensación solitaria o en paroxismo y separado por intervalos libres de dolor. Paciente con NT atípico casi siempre refieren historial de dolor cortante paroxístico, sin embargo, pueden presentar otro tipo de dolor y en presentación atípica. Muchos pacientes sometidos a intervenciones terapéuticas tienen esta presentación atípica. Los criterios diagnósticos de la NT están descritos por la Clasificación Internacional de Trastornos de Cefalea (ICHD-3), (5) en la tabla 1.
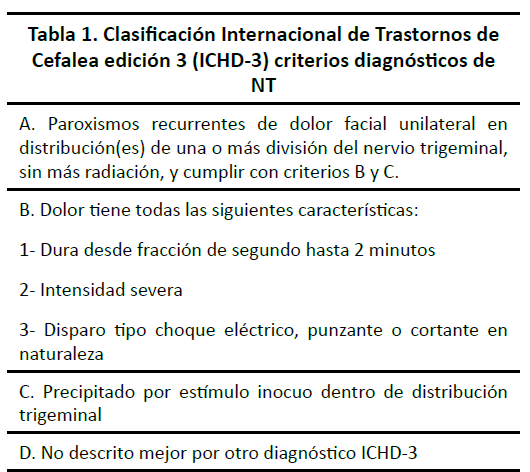
Se subclasifica en clásica, secundaria o idiopática, dependiendo de causa subyacente. El tipo clásico (75 % de los casos) se diagnostica cuando hay una compresión neurovascular trigeminal con cambios morfológicos ipsilaterales (distorsión, indentación o atrofia) del lado de dolor, demostrado en resonancia magnética con secuencias trigeminales o durante cirugía. El tipo secundario (15 % de los casos) se atribuye a una enfermedad neurológica subyacente identificable (excepto compresión trigeminal neurovascular) como tumor ángulo cerebelopontino, malformación arteriovenosa y esclerosis múltiple. El tipo idiopático comprende el resto de los casos, los cuales se confirman cuando no existe una causa aparente de la NT.
La presentación clínica suele será más común lado derecho de la cara (60 %) (14) la presentación bilateral es rara (1.5-5 %). El dolor afecta más frecuentemente las distribuciones maxilares (V2) y mandibulares (V3). El dolor dura <2 minutos en 75 % de los casos, aunque otros se prolongan hasta 10 minutos. El número de episodios va desde pocos hasta cientos en un día, aproximadamente 40 % de pacientes reportan >10 ataques al día. (15) Un signo patognomónico de la NT son gatillos de dolor por mecanismos aparentemente inocuos, ocurre en >90 % de los pacientes. El gatillo más potente es la estimulación táctil ligera, los más comunes incluyen: toque ligero, masticar, lavado de dientes, comer, beber o rasurar. Las zonas gatillo más comunes incluyen pliegue nasolabial, labio superior, parte lateral de labio inferior, mentón, y mucosa alveolar. (16)
El estándar de oro diagnóstico es la imagen por resonancia magnética para excluir etiologías secundarias de la NT. (17) Es importante para subclasificar en tipo clásico o idiopático, sobre todo para referencia a DMV cuando está indicado. Se detecta la presencia de etiología neurovascular, el tipo de estructura vascular (arteria, vena o ambos) y grado de compresión. El protocolo debe usar combinación de tres secuencias de alta resolución que incluye secuencias FIESTA, DRIVE, CISS incluyendo secuencias ponderadas en T2 3D y angiografía por resonancia magnética con TOF y T1 con reconstrucción 3D. (1) La evaluación con resonancia magnética tiene sensibilidad 98 %, especificidad 100 %, valor predictivo positivo 93 % y valor predictivo negativo 97 %. (18) Otros métodos de abordaje incluyen tomografía computarizada de cráneo, angiograma cerebral con tomografía computarizada y potenciales evocados trigeminales y/o grabaciones neurofisiológicas de reflejos trigeminales.
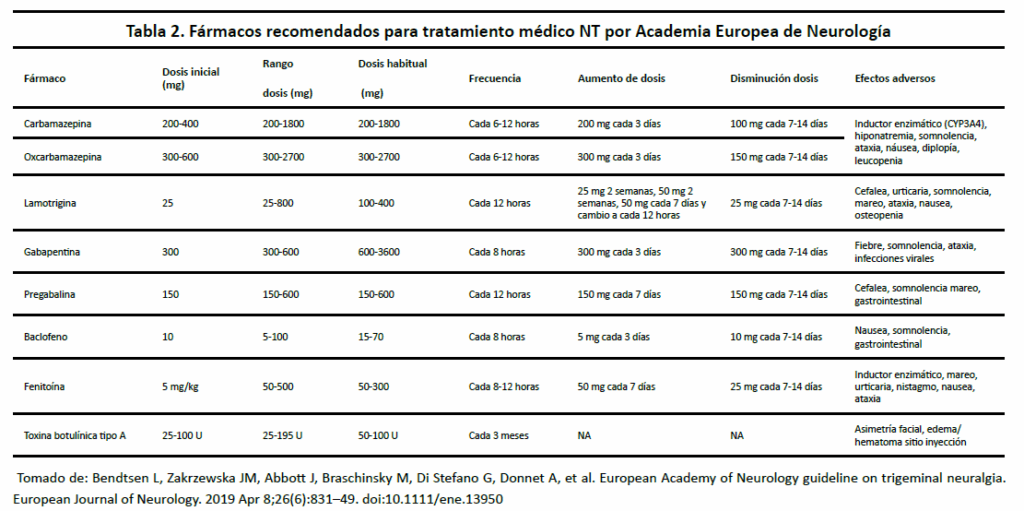
La base de la terapia farmacológica es tratamiento preventivo, no es útil usar tratamientos abortivos debido a la brevedad de los ataques. La mayoría de estos tratamientos no cuentan con buena calidad de evidencia para su uso, sin embargo, la experiencia clínica ha sido aceptable y seguro. Se prefiere monoterapia, algunos pacientes requerirán de múltiples fármacos para adecuado control. La primera línea de tratamiento farmacológico es carbamazepina y oxcarbamazepina, proveen adecuado control inicial de dolor en hasta 90 % de los pacientes, a pesar de buena respuesta puede que no sea sostenida a largo plazo. (1) La desventaja de estos fármacos son sus efectos adversos que causa suspensión de tratamiento en hasta 40 % de los pacientes. Ambos fármacos presentan múltiples interacciones farmacológicas, depresión sistema nervioso central o hiponatremia. Está descrito Síndrome Stevens-Johnson y Necrólisis Epidérmica Tóxica con el alelo HLA-B*1502, la cual ha resultado común en población China Han. La lamotrigina ha sido reportada como monoterapia o una terapia adicional a otros fármacos. Suele tener menos efectos adversos que otros fármacos, la dosis se debe de escalar paulatinamente para evitar cambios cutáneos. El baclofeno puede ser útil en pacientes que padecen esclerosis múltiples y que consumen ese fármaco para tratamiento de espasticidad. Una nueva terapia descrita recientemente es el uso de toxina botulínica inyectada en zonas gatillos. Otras terapias investigadas recientemente son fenitoína, tizanadina, levetiracetam, misoprostol, topiramato, pimozida, duloxetina, eslicarbazepina y vixotrigina. (2) Existen tres tipos de intervenciones quirúrgicas: 1) invasivo, no ablativo (e.j. DMV), 2) invasiva, ablativo (lesión controlada de ganglio o raíz trigeminal mediante medios mecánicos (e.j. compresión con balón), térmicos (e.j. termocoagulación con radiofrecuencia), químicos (e.j. rizólisis por glicerol), separación de fascículos de nervio trigeminal en fosa posterior (e.j. neurólisis interna) y, 3) no invasivo, ablativo (e.j. radiocirugía esterotáctico con enfoque de radiación en zona de entrada de raíz trigeminal).
Nuestra búsqueda identificó 582 estudios en base de datos, después de remover aquellos que no cumplieran con los criterios de inclusión para la revisión, se obtuvieron 101 artículos evaluados. (Figura 1). Se incluyeron al final 71 estudios en la revisión final.
1- Farmacoterapia
La base de la terapia farmacológica es tratamiento preventivo, no es útil usar tratamientos abortivos debido a la brevedad de los ataques. La mayoría de estos tratamientos no cuentan con buena calidad de evidencia para su uso, sin embargo, la experiencia clínica ha sido aceptable y seguro. Se prefiere monoterapia, algunos pacientes requerirán de múltiples fármacos para adecuado control.
A- Tratamiento de exacerbaciones
Un ataque único es generalmente demasiado corto para ser tratado por intervención médica, en algunas ocasiones puede presentarse alta frecuencia de ataques que requiere tratamiento abortivo intravenoso a la brevedad. Las opciones terapéuticas con evidencia hasta el momento son inyecciones de lidocaína en zonas gatillo, infusión intravenosa de lidocaína, fenitoína o fosfofenitoína. (19)
La fenitoína se administra a 15-20 mg/kg intravenoso a una velocidad máxima de 2 mg/kg/min o 150 mg/minuto. Efectos adversos incluyen: bloqueo de conducción cardíaca, reacciones de hipersensibilidad, urticaria, cefalea, nistagmo, somnolencia y fatiga. (20, 21)
Un estudio retrospectivo analizó el efecto de fosfenitoína en exacerbaciones de NT, se administró 750 mg a 20 pacientes. Se observó una disminución significativa de dolor, con EVA inicial de 10 y números reportados de 2.35, 0.65, 0.15, 2.0, 4.3 a los 15, 30, 60 minutos y 12 y 24 horas, respectivamente. Se presentó solamente mareo leve, aunque todos los pacientes pudieron deambular dentro de los 60 minutos de administrado el fármaco. (22)
El tratamiento con lidocaína intravenosa está descrito como efectiva en dosis de 5 mg/kg en infusión continuo, administrada en una hora. Efectos adversos incluyen: depresión cardíaca, hipotensión y arritmias. (23)
También se puede colocar lidocaína al 10% intranasal (intraoral en su defecto), lidocaína al 5% sobre área gatillo e infiltración local con lidocaína al 2% con epinefrina en áreas gatillo. (24)
Un estudio retrospectivo comparó el uso de lacosamida y fenitoína intravenosos para exacerbaciones de dolor en NT, (25) el análisis de 144 casos encontró efectividad de alivio de dolor de 77.8 % y 72.8 % (P = 0.497) en los grupos de lacosamida y fenitoína, respectivamente. Mientras que los efectos adversos fueron de 1.6 % y 12.3 % (P = 0.023).
El uso de lacosamida también se asoció con menos readmisiones a 6 meses, tiempo a readmisión y alivio de dolor en visitas de seguimiento.
Se han descrito también bloqueos en el área de urgencias para exacerbaciones de NT refractaria, los bloqueos utilizados son: supraorbitario junto con auriculotemporal. En este estudio de serie de casos, siete de nueve pacientes fueron libres de dolor de forma inmediata con 6 de 9 pacientes presentando alivio de dolor sostenido hasta a 8 meses (3 pacientes dolor tolerable con apoyo de medicación adyuvante y 2 pacientes estando libre dolor). (26)
B- Tratamiento Crónico
a. Alternativas Farmacológicas de primera línea
La primera línea de tratamiento farmacológico recomendada por Academia Americana de Neurología es carbamazepina y oxcarbamazepina, proveen adecuado control inicial de dolor en hasta 90 % de los pacientes con reducción de intensidad y frecuencia de ataques con número requerido para tratar (NNT) de 1.8 (27).
Ambos causan un bloqueo de canales de sodio en membranas neuronales durante estimulaciones de alta frecuencia, reduciendo la propagación de señal eléctrica y limitando la actividad ectópica. (28)
A pesar de buena respuesta puede que no sea sostenida a largo plazo debido a inducción de enzimas hepáticas y taquifilaxia, necesidad de aumento de dosis y mayor riesgo de efectos adversos con uso prolongado. (1)
Los niveles terapéuticos sanguíneos son de 4 a 12 μg/mL. Si no se responde adecuada a una de las dos se puede intentar con el otro fármaco (200 mg carbamazepina es equivalente 300 mg oxcarbamazepina), sin embargo, si una de las dos tiene como consecuencia reacción no debe de intentarse el otro ya que existen reacciones cruzadas con probabilidad alta entre las dos. (29)
La oxcarbamazepina es metabolizado por enzimas citosólicas (a diferencia por procesos oxidativos por citocromo P450 de carbamazepina) con menor riesgo de interacciones farmacológicas. (28)
La desventaja de estos fármacos son sus efectos adversos que causa suspensión de tratamiento en hasta 40 % de los pacientes. Ambos fármacos presentan múltiples interacciones farmacológicas, migrañas, mareo, náusea y vómito, depresión sistema nervioso central, hiponatremia. Está descrito, Síndrome Stevens-Johnson y Necrólisis Epidérmica Tóxica con el alelo HLA-B*1502, la cual ha resultado común en población China Han.
La oxcarbamazepina podría ser preferida por menor interacción farmacológica y mejor tolerabilidad.
b. Alternativas Farmacológicas (segunda línea)
i. Lamotrigina
Su potencial en el tratamiento de NT es mediante bloqueadores de canales de sodio, inhibición canales calcio activados por alto voltaje tipo N y P y aumento de corrientes repolarizantes de potasio. Ha sido reportada como monoterapia o una terapia adicional a otros fármacos. Suele tener menos efectos adversos que otros fármacos, la dosis se debe de escalar paulatinamente para evitar cambios cutáneos. Se presenta el síndrome de Stevens-Johnson en uno de cada 10,000 pacientes. (30) Existe recomendaciones de lamotrigina como adyuvante o monoterapia para manejo de dolor de NT (31).
ii. Gabapentina/Pregabalina
Gabapentinoides tienen posible efecto analgésico con acción sobre subunidad alfa-2-delta de canales calcio regulados por voltaje (VGCCs) con reducción de transmisión de neurotransmisores y excitabilidad neuronal mediante agonismo GABA. También existe acción de estabilización membranal por efecto selectivo sobre conductos lentos de canales de Na+. Existe también supresión de receptores espinales de N-metil-d-aspártico (NMDA), activación canales potasio con hiperpolarización neuronal, inhibición vías serotonérgicas y activación de vías inhibitorias descendentes noradrenérgicas. (32-34) Siguen siendo recomendados como adyuvantes para el tratamiento de mantenimiento para NT.
iii. Fenitoína
Fue el primer fármaco utilizado para el tratamiento de NT en 1942, (35) se usó hasta que se demostró mejor efectividad de carbamazepina en 1959. Se considera un bloqueador débil de VGCCs a potenciales de membrana hiperpolarizadas pero su acción inhibitoria es potenciada con despolarización membrana sostenida y durante actividad de canal de alta frecuencia (36). Sigue siendo medicamento utilizado para casos de exacerbación de dolor como rescate intravenoso o de enfermedad refractaria (37). Su uso crónico no es recomendado por alto perfil de complicaciones a largo plazo.
iv. Baclofeno
Es un agonista receptor GABAB que actúa sobre la subunidad beta de receptores expresados en neuronas a nivel de médula espinal y cerebro. Puede ser útil en pacientes que padecen esclerosis múltiple con NT y que consumen ese fármaco para tratamiento de espasticidad. Cuando es utilizado para tratamiento de NT, reduce el número de episodios dolorosos y prolonga la remisión (38). Su uso es limitado por efectos adversos (25-75 %) secundario a una ventana terapéutica reducida, incluyen: debilidad muscular, nausea, somnolencia y parestesias (39). Un retiro abrupto de la toma del fármaco puede causar un síndrome de abstinencia severo presentando con complicaciones que ponen en riesgo la vida (hipertermia, hiperreflexia, alucinaciones, cefalea, delirium, crisis epilépticas y falla multiorgánica) (38).
v. Botox
Una nueva terapia descrita recientemente es el uso de toxina botulínica inyectada en zonas gatillos. La toxina botulínica tipo A (BTX-A) es una neurotoxina derivada de la bacteria Clostridium botulinum, la cual inhibe la liberación de acetilcolina en las uniones neuromusculares, causando relajación de los músculos, reducción secreción de neurotransmisores moduladores nociceptivas periféricas, reducción de sensibilización central por glutamato y/o sustancia P, así como reducción de expresión de canales iónicos en el núcleo trigeminal espinal. (40-42)
Un ensayo clínico aleatorizado, doble ciego investigó la eficacia del tratamiento de botox para NT. Se administró toxina botulínica tipo A intradérmica y/o submucosa en distribución de área dolorosa, con un total de 75 U en 15 sitio de inyección; el grupo placebo se realizó lo mismo, pero con solución salina 0.9 %. Pacientes con >50 % reducción en escalas visual analógicas (EVA) fue el desenlace primario y se consideraron respondedores a tratamiento. Hubo repuesta a tratamiento en 68.18 % del grupo toxina botulínica tipo A y 15 % grupo placebo, se reportó mejoría significativa en 77.27 % grupo toxina botulínica tipo A y 20 % grupo placebo y reducción de frecuencia de ataques en grupo toxina botulínica tipo A (todos estadísticamente significativo) (43).
Un estudio aleatorizado por Liu et al comparó efectividad de toxina botulínica tipo A en pacientes mayores de 80 años (n = 14) y menores de 60 años (n= 29). Se utilizaron dosis desde 30 U hasta 200 U y desde 45 U hasta 150 U en pacientes de <60 años y >80 años, respectivamente. Un mes de seguimiento posterior al tratamiento, las escalas visual analógicas (EVA) disminuyeron de 8.5 a 4.5 (>80 años) y 8.0 a 4.0 (<60 años) de forma estadísticamente significativa. (44) Se ha comparado dosificación única versus dosis repetidas (2 citas para colocación de toxina botulínica tipo A) en tratamiento de NT. En ambos grupos, la tasa de respuesta a fármaco y escalas de dolor fueron similares y no estadísticamente significativo. También se observó que la duración de eficacia fue significativamente prolongada en el grupo de dosis única, por lo que se recomienda ese esquema para aplicación de toxina botulínica tipo A en paciente con NT. (45) Un estudio retrospectivo de Zhang et al. (46) encontró efectividad de toxina botulínica tipo A para tratamiento de NT, siendo efectivo (reducción escala visual analógica 50-70 %) en 20.4 %, significativamente efectivo (reducción dolor >75 %) en 13.8 % y completamente efectivo (reducción dolor 100%) en 54.6 %; teniendo una tasa efectiva general de 89.4 %. Se observó mejor respuesta a tratamiento en pacientes jóvenes (<70 años) y con dosis más altas. Un estudio retrospectivo de Wu et al. encontró lo contrario con la edad >50 años teniendo una asociación independiente con responder a tratamiento con toxina botulínica A para NT (P = 0.02) (47).
Las últimas recomendaciones son utilizarlo como monoterapia, terapia adyuvante o en casos refractarios. Un estudio respectivo reciente de Asan et al encontró que la toxina botulínica A es también efectiva para el tratamiento de NT relacionado con esclerosis múltiple, con tasas de respuesta terapéutica similares a NT primaria (48).
vi. Lacosamida
Es un bloqueador de canales de sodio de voltaje de una forma lenta con un perfil menor de efectos adversos comparado con otros fármacos anticonvulsivantes. Se ha utilizado en casos de NT refractario a otros tratamientos. Un estudio retrospectivo de Muñoz-Vendrell (50), concluyó que esta era efectiva y relativamente segura para tratamiento del dolor refractario de NT después de un fracaso de tratamiento de primera línea. En 86 pacientes, se consiguió alivio de dolor en 57/86 (66 %) casos, con 28/86 (33 %) pacientes presentando efectos adversos (todos leves).
vii. Vixotrigina
Es un bloqueador de canales de sodio selectiva de canal Na 1.7 dependiente de estado, con buen perfil de tolerabilidad en estudios clínicos de fase 1 y 2a, actualmente se encuentra en estudio la utilidad de esta para NT en estudios fase 3. (51)
viii. Eslicarbazepina
Es un metabolito activo de oxcarbamazepina aprobado en Europa en 2009 y por la FDA en el 2013 para crisis epilépticos de inicio focal. En el 2018, un estudio retrospectivo analizó su efectividad para el tratamiento de NT donde resultó ser efectivo (escala visual analógica de 9.5 a 2.4 (p < 0.001) y frecuencia semanal de paroxismo de 70 a 0.37 (p < 0.001)), seguro y bien tolerado para tratamiento de NT (52).
ix. Erunumab Es un anticuerpo monoclonal contra receptores del péptido relacionado con genes de calcitonina (CGRP) aprobado para tratamiento preventivo de migraña. Un estudio (53) aplicó este tratamiento en 10 pacientes con NT refractaria donde se reportó una reducción significativa de dolor y mejoría global de calidad de vida a 6 meses. Existen múltiples estudios activos analizando a fondo esta nueva terapéutica para NT.
2- Procedimientos Neuroquirúrgicos
Por lo general, no existe consenso cuando debe de considerarse intervención quirúrgica. Se sugiere que por lo menos se utilice carbamazepina o oxcarbamazepina junto con un fármaco de segunda línea, ambos a dosis máximas (con tolerancia de efectos adversos) (31). La segunda línea terapéutica es quirúrgica y se reserva para paciente con dolor incontrolable tratado con fármacos o en aquellos que tienen efectos adversos relacionados a medicamentos. Las tres técnicas quirúrgicas principales son DMV, procedimientos percutáneos (microcompresión con balón), inyección de glicerol, termocoagulación radiofrecuencia y radiocirugía estereotáctica. A) Invasivo y no ablativa a. Descompresión microvascular (DMV) Es la primera línea de tratamiento con mejores desenlaces a mediano y largo plazo. Es el tratamiento de elección para NT clásica, para idiopática la DMV y procedimientos de ablación son primeras opciones equivalentes, si no hay contacto neurovascular los procedimientos de ablación son de elección de primera línea (31). La DMV es un procedimiento microquirúrgico no ablativo, a través de abordaje retrosigmoideo, donde se exploran las relaciones en cisterna cerebelopontino. Frecuentemente, existen compresiones del nervio trigémino por la arteria cerebelosa superior o el complejo de la vena petrosa superior (49). Una vez identificado sitio de compresión, se diseca la arteria del nervio, se transpone y se separa del nervio con politetrafluoroetileno (Teflón). Si no se identifica compresión neurovascular durante intervención, se realiza rizotomía retroGasseriano por sección o compresión transitoria del nervio (54). El control del dolor inicial es variable, del 80-96 %. (55) Desenlaces tardíos reportan libre de dolor en hasta 70 % de los pacientes. (56) Puede ser de utilidad limitada en la población geriátrica por complicaciones relacionados al procedimiento anestésico-quirúrgico. Factores que predicen una adecuada respuesta a tratamiento incluyen: compresión neurovascular identificado, puntos de gatillo para dolor, sexo masculino, ausencia de compresión venosa y menor duración de enfermedad (57). Presenta mayor riesgo, con las siguientes complicaciones: parálisis pares craneales (4 %), anacusia (1.8 %), hipoestesia facial (3 %), meningitis (0.4 %), edema/hemorragia/infarto cerebral (0.6 %), anestesia dolorosa (0.02 %), muerte (0.3 %) (58, 31). En una revisión reciente, la tasa de mortalidad fue de 0.3 %, complicaciones neurológicas mayores 0.4 % y prolongación de estancia hospitalaria en 2.8 %. Predictores independientes de cualquier evento adverso fueron ASA III-IV y procedimientos quirúrgicos largos. Predictores de reingreso posoperatorias fueron clasificación ASA alta, diabetes mellitus y tiempos operatorios altos (59). Una revisión retrospectiva encontró una tasa de complicaciones severas en el 1.17 % de pacientes (N = 596 pacientes) presentando: infarto cerebelar con hidrocefalia aguda, infarto cerebelar y de tallo cerebral con hidrocefalia e infección intracerebral, hematoma subdural supratentorial y edema cerebelar con hidrocefalia aguda. De estos, 1 paciente falleció y 1 permaneció en estado vegetativo, los otros cinco fueron egresados a domicilio (60). Un estudio prospectivo de Mizobuchi et al (61) evaluó desenlaces a corto y largo plazo, así como complicaciones en pacientes en que se les realizó DMV para tratamiento de NT. El estudio analizó a 166 pacientes, se consiguió alivio completo de dolor en 78.9 %, se presentó mortalidad de 0 % y complicaciones en 16.3 %. El seguimiento a largo plazo se completó en 155 pacientes (93.4 %) con tasas de alivio completo de dolor en 80 % y complicaciones en 5.2 %. Concluyeron que en manos de neurocirujanos expertos la DMV alcanza altas tasas de curación y que las complicaciones son raras y usualmente transitorias. Factores de riesgo para presentar recurrencia según un metaanálisis reciente son: síntomas atípicos, ausencia de surco neuronal, compresión no arterial, 50-60 años y mayor duración de enfermedad (62). Un estudio retrospectivo de Li et al (63) comparó desenlaces en pacientes con NT tratados con DMV y radiocirugía estereotáctica. Se analizaron 111 pacientes en grupo DMV y 103 pacientes radiocirugía estereotáctica, el análisis de regresión ordinal multivariado encontró puntaje BNI I-II (P=0.365) y III (P=0.736) es alcanzable con DMV o radiocirugía estereotáctica; sin embargo, puntaje BNI IV (P=0.031) y V (P=0.022) eran más asociados con grupo radiocirugía estereotáctica. Del grupo de DMV, 6 % y del grupo radiocirugía estereotáctica 26 % desarrollaron recurrencia del dolor y requirieron una segunda intervención. Nueve de 10 pacientes que entraron a DMV después de radiocirugía estereotáctica fallida tuvieron alivio completo de dolor. b. Neurólisis Interna Es una técnica quirúrgica con abordaje abierta en fosa posterior, donde se realiza división longitudinal de la raíz sensitiva de la raíz del NT, y la distancia depende de la morfología individual del NT. Un estudio retrospectivo de 27 pacientes encontró alivio inmediato de dolor en 92.6 % de los casos, no se realizó seguimiento a largo plazo. Como efecto adverso, el 88.9 % de los pacientes presentaron entumecimiento o hipoestesia de cara ipsilateral. (64) Otro estudio retrospectivo con 8 pacientes encontró que con la neurólisis interna el 100 % de pacientes estaban libre de dolor en el posoperatorio inmediato y a 3 meses de seguimiento, a los 6 meses 75 % persistía libre de dolor. (65) Un estudio por Sabourin et al (66) retrospectivo analizó a 32 pacientes, 19 de ellos entrando a DMV + neurólisis interna y 12 a solamente neurólisis interna. Presentaron excelentes resultados, concluyendo que la neurólisis interna con o sin DMV es una opción de tratamiento para pacientes cuidadosamente seleccionados con NT. B) Invasiva y ablativa Terapias ablativas se definen como procedimientos que tienen como objetivo la destrucción del nervio trigeminal mediante lesión controlada por distintos medios (físicos, químicos, radiofrecuencia, etc.). Algunos pacientes con NT clásica son pobres candidatos a DMV: Pacientes con esclerosis múltiple, pacientes con terapia médica fallida, pacientes frágiles o de edad avanzada con pobre tolerancia para procedimiento quirúrgico, pacientes con ausencia de contacto neurovascular demostrado por estudios de imagenología de alta resolución. En estos pacientes, la rizotomía trigeminal percutánea es una opción atractiva. En general, la técnica consiste en inserción percutánea hacia la cueva de Meckel con denervación mediante distintas técnicas/mecanismos. Se usan los puntos de referencia de Haertel para entrar al foramen usando punto de entrada dos centímetros laterales y un centímetro inferior de la esquina de la boca y escogiendo trayectoria hacia intersección de línea media pupilar y trago. Se puede confirmar posición correcta con retorno de líquido cefalorraquídeo y/o reflejo mandibular. Una vez con adecuada localización, se produce una lesión mediante las diferentes técnicas descritas a continuación. Se cree que la neurólisis química causa lisis selectiva de la vaina axonal sobre fibras nerviosas dañadas y previene la descarga neuronal aberrante o que la normalización de sumación temporal de potenciales sinápticos dentro del ganglio trigeminal causa reducción de dolor (67). Los distintos tratamientos percutáneos son seguros y efectivos y proveen una adecuada tasa inicial de alivio de dolor. Aunque la DMV sigue siendo el estándar de oro, las técnicas percutáneas tienen su lugar en el abordaje terapéutico de esta enfermedad. a. Rizólisis por balón (medio físico) En 1983, se describió por primera vez la inserción exitosa percutánea de catéter de balón Fogarty para comprimir el ganglio trigeminal (68). La inflación del balón causa lesión mecánica al ganglio trigeminal y raíces pregangliónicas mediante lesión selectiva de fibras nociceptivas medianas y grandes mientras son conservadas fibras pequeñas, lo cual permite preservar función motora y sensitiva y teóricamente, el reflejo corneal. Es una excelente opción de tratamiento en pacientes con contraindicación para otros procedimientos más invasivos o de mayor edad. Tiene ventajas de ser de bajo costo, simple de realizar y se realiza bajo anestesia general. Consiste en insertar aguja 15 G en foramen oval avanzando un balón Fogarty tamaño 4 guiado con fluoroscopio y con paciente bajo anestesia general. Se infla balón con medio de contraste con volumen de 0.7-0.75 cc y presión de 1000-1200 mm Hg, se mantiene durante 60-10 segundos (69). El punto crucial de esta técnica que es equitativo a éxito quirúrgico es tomar una forma de “pera”, visualizado por fluoroscopio con el balón dentro de la cueva de Meckel (70). La tasa de respuesta inicial 94 % pero con recurrencia al año de 25 % y a largo plazo 69 %. La tasa de recurrencia varía de 25.4 % a 1 año y 19.2-25.4 % a 5 años. Otro estudio retrospectivo encontró una tasa de alivio inmediato de dolor en 97.1 % de los pacientes. (71) Un estudio retrospectivo comparó la efectividad de compresión percutánea con balón con DMV en 98 pacientes, (72) con un resultado de que no hubo diferencias significativas de alivio de dolor o eficacia a largo plazo entre los dos grupos (P>0.05). La tasa de complicaciones fue significativamente menor en grupo de compresión percutánea con balón comparado con DMV (3.77 % vs 17.78 %, P <0.05). Un estudio prospectivo comparando múltiples procedimientos percutáneos para tratamiento de NT encontró que, de todas, la compresión percutánea con balón fue la técnica que presentó mayor alivio de dolor durante mayor tiempo. (73) En comparación con otras técnicas percutáneas, esta se realiza bajo anestesia general (optimiza comodidad de paciente), no requiere cooperación del paciente y es selectiva para fibras mielinizadas grandes y medianas (preservando fibras pequeñas).
La inserción de balón percutánea asistida por robot es un método seguro y eficaz. Un estudio prospectivo aleatorizado encontró que, en comparación con técnica anatómica guiado por fluoroscopio, el asistido por robot tuvo mayor tasa de éxito de punción al primer intento, mayor número casos exitosos, menor uso de rayos X, mejor eficacia a corto plazo y menos complicaciones relacionadas al procedimiento (74).
El procedimiento no genera un alivio inicial de dolor, esto puede ser secundario a diferencias en tamaño de cueva de Meckel, diferencias en presión alcanzada con balón y diferencias en tiempo de compresión. Factores de buen pronóstico para determinar eficacia de la compresión son: dolor en solamente una división, ausencia de intervenciones previas, tiempo de compresión menos de cinco minutos y balón en forma de pera.
Las complicaciones descritas son: entumecimiento facial (4.6-40 %), disestesia (1-11.4 %), debilidad músculo masetero (59 %), parestesias (9 %), diplopía (<2 %), anestesia dolorosa (0-3.4 %), meningitis aséptica (0.7 %) y bacteriana (0.7-1 %) (23,98). También al momento de inflar balón puede presentarse cambios hemodinámicos (presión arterial y/o frecuencia cardíaca) debido a reflejos cardíacos secundario a compresión del nervio trigémino. b. Rizólisis por Radiofrecuencia (medio térmico) Técnica mínimamente invasiva para tratamiento NT que es segura y efectiva. La técnica habitual consiste en identificar el foramen oval usando fluoroscopio en vista submental hasta llegar al ganglio semilunar y coagular el nervio trigémino. El principio por el cual actúa es destrucción del tejido nervioso con altas temperaturas (mayor de 90°C) o modulación de la función nociceptiva del nervio con temperaturas más bajas mediante inhibición de fibras C y modulando liberación de mediadores inmunitarias inflamatorias (menor de 42°C). Se inserta aguja 20 G con punta activa de radiofrecuencia colocado dentro de cueva de Meckel en abordaje de coaxial. Dependiendo de la técnica, se aplica en ese momento la radiofrecuencia. La radiofrecuencia puede generarse en forma continua (RFC), en pulsos (RFP) o combinada (RFCC). En caso de RFC, la fricción y vibración producen calor, causando termocoagulación y desnaturalización proteica con necrosis en el tejido diana. En la RFP, se emplea una menor temperatura y se transmite la energía en forma de pulsos o intervalos, involucra la generación de 20 milisegundos de corriente pulsado con período silente de 480 milisegundos a 42 grados Celsius. Se considera una técnica más segura, pero tiene mayor incidencia de recurrencia. En contraste, la CRFT es un procedimiento percutáneo que involucra ablación térmica de ganglio Gasseriano, usualmente entre 65 y 80 grados Celsius. Las tasas de curación con RFC y RFP no tienen diferencias significativas, pero RFC es más efectiva que la RFCC. Entre RFP y RFC tampoco hay diferencias significativas en cuanto a complicaciones y en general aumentan conforme se aumenta la temperatura del tratamiento, fueron: disestesia, anestesia dolorosa (0.6-0.8 %), debilidad músculo masetero (4 %), entumecimiento facial, queratitis (2 %) (75). La técnica tiene múltiples ventajas: buenos resultados en cuanto a resolución de dolor, menor trauma y riesgo. Está indicado en pacientes con contraindicaciones para cirugía, especialmente pacientes geriátricos y/o con múltiples comorbilidades. Un estudio retrospectivo por Gunduz et al concluyó que la radiofrecuencia percutánea es un tratamiento efectivo para NT, especialmente de forma inicial con una efectividad de hasta 92 % y mejoría importante en pacientes con enfermedad avanzada. Con el paso del tiempo la efectividad del tratamiento disminuye, aun así, puede repetirse la intervención con excelentes resultados. (76) Otro estudio que incluyó 100 pacientes encontró una tasa de éxito del 98 % a una media de seguimiento a 12 meses. (77) Un estudio publicado en la revista de Cirugía Craniofacial en 2020 reportó que la radiofrecuencia era costo efectivo comparado con DMV para el tratamiento de NT (78). Un estudio doble ciego, aleatorizado y controlado comparó ablación con radiofrecuencia percutánea con placebo para tratamiento de NT. Se aplicó radiofrecuencia 75°C durante 60 segundos mientras que en grupo placebo se dejó en lugar 60 segundos sin aplicación de radiofrecuencia. A un mes de seguimiento, el dolor en escala visual analógica disminuyó de 9.2 a 0.7 en el grupo de radiofrecuencia y 8.9 a 5.8 en grupo placebo (79). Un estudio clínico observacional multicéntrico buscó evaluar la eficacia a largo plazo de radiofrecuencia a diferentes temperaturas. Se encontró que una temperatura óptima debe seleccionarse de acuerdo a las ramas del nervio trigémino afectadas. Si V1 está involucrada, se recomienda 60-65 °C, 72 °C para V2 y 75 °C para V2/V3. Para RFP, se recomienda 45-50 °C para pacientes geriátricos. (80) Un estudio retrospectivo buscó encontrar factores de riesgo para recurrencia de dolor en pacientes con NT tratados con termocoagulación con radiofrecuencia percutánea. Se encontró que las siguientes eran factores de riesgos significativos: dolor facial atípico, Barrow Neurological Institute (BNI) clase II/III, hipoestesia facial previo a procedimiento o antecedente de ≥2 intervenciones previas (81). Un estudio retrospectivo reciente (82) observó que los desenlaces entre rizólisis por balón y radiofrecuencia son igual de efectivas para alivio inicial de dolor (84.2%) y supervivencia libre de recurrencia (aproximadamente 450 días) con una incidencia baja de complicaciones (22.2%) y sin casos de muertes asociadas. c. Rizólisis con inyección de químicos (medio químico) El uso de inyecciones periféricas de alcohol se ha utilizado para el tratamiento de NT desde principios del Siglo XX. Se empleó de forma parcialmente exitosa, sin embargo, con una alta tasa de incidencia de complicaciones severas. En la búsqueda de alternativas químicas se empezó a utilizar fenol y glicerol. El fenol se ha utilizado como agente neurolítico desde 1926, sus mecanismos de acción incluyen desnaturalización de proteínas, pérdida de contenido grasa celular y separación de vaina de mielina del axón llevando a destrucción neural selectiva, atrofia muscular y necrosis. Su uso para tratamiento de NT está descrito desde los años 60s (83), con efectividad aceptable, no existen estudios de actualización o recientes utilizando este agente. (84) Por su alto perfil de toxicidad, su uso más común ha sido con pacientes paliativos con cáncer en estadio terminal. El glicerol es un líquido viscoso, sin color y sin olor. A concentraciones (>99 %), es altamente hipertónica y causa neurólisis mediante fragmentación de mielina o directamente mediante penetración al perineuro. La técnica consiste en la inyección de 0.2-0.5 cc de 99.9 % glicerol anhidroso en el ganglio Gasseriano a través aguja 20 G insertado a través foramen oval. Se puede realizar por vía percutánea o por vía abierta bajo visión microscópica. El drenaje de contraste puede ser por flujo pasivo de la cisterna o regresando a la posición supina. La inyección de glicerol se realiza con paciente en posición sedente. Para dolor multidivisional se inyecta el volumen completo de glicerol. Para dolor de V1, se inyecta glicerol antes del drenaje completo de material de contraste. Glicerol es relativamente menos denso que contraste y subirá del mismo, tratando selectivamente V1. De forma similar para aislar V3, solamente 1/3 de volumen cisternal de glicerol es utilizado. Después de la inyección, el paciente se queda en posición sedente durante varios minutos.
Se ha reportado una tasa de éxito del 92.1 %, con una duración del efecto en promedio de 11 meses con un tiempo promedio de reinyección de 23 meses. La principal complicación reportada fue el entumecimiento facial (23.3-72 %). También se ha presentado disminución de la sensación corneal (16 %), anestesia dolorosa 0-5 %, debilidad masticatoria 0-4.1 % y meningitis aséptica (0.12-3 %) o bacteriana (1.5-1.7 %) (86). La desventaja principal es el tiempo que tarda en presentarse mejoría sustancial, hasta 7-19 días, así como altas tasas de falla primaria y recurrencia. Esta técnica también se ha realizado de forma exitosa con uso de tecnología de Neuronavegación electromagnética sin marco estereotáctico (87).
Un estudio retrospectivo de cohorte de Bethamcharla et al (88) analizó el desenlace de ablación con glicerol en 45 pacientes con 66 procedimientos. Demostró que 87.9 % de los pacientes tratados con glicerol presentaron con BNI score de I (alivio de dolor sin medicación) aproximadamente a los 10 días de aplicado el tratamiento. A un seguimiento mediano de 3 años, 18 procedimientos (27.3 %) resultaron en un BNI I, 12 procedimientos (18.1%) resultaron en un BNI IIIa y 36 procedimientos (54.5 %) resultaron en BNI IIIb-V. El tiempo mediano libre de dolor sin medicación fue de 1.5 años.
Una técnica nueva descrita recientemente involucra medir el volumen de la cueva de Meckel intraoperatorio e inyectar un volumen equitativo en la cueva de Meckel de forma que cada paciente recibe un volumen personalizado de glicerol. Esta técnica es segura y efectiva comparado con desenlaces reportados en la literatura con volúmenes estándar de glicerol. Un estudio retrospectivo encontró una tasa de alivio de 85 % general y 92 % en casos de NT típica. Duración mediana libre de dolor fue de 63 meses en casos de NT típica versus seis meses en casos NT secundarios. La presencia de hipoestesia postprocedimiento fue altamente predictivo de duración prolongada libre de dolor (mediana 95 meses versus 8 meses libre de dolor; p=0.00003) (89).
d. Neurectomía
Involucra la desconexión quirúrgica de ramas periféricas del nervio trigémino. Suele ser opción de rescate para pacientes con múltiples tratamientos fallidos. Se realiza una avulsión parcial de ramos distales del nervio trigémino (frecuente nervio alveolar inferior), ofrece baja calidad en alivio de dolor, ofreciendo control a corto y mediano plazo, no considerada como opción terapéutica de primera línea.
Tasas iniciales de alivio de dolor varían entre 90 % a 97.6 % para todas las técnicas, a 3 años la tasa de alivio de dolor disminuye a 53-69 % con entumecimiento severo en 20-23 % de los pacientes. Presentan notables tasas de recurrencia (hasta 26 % en período de 18 meses). Las posibles complicaciones incluyen: disestesias (4-10 %), queratitis corneal (0-2 %), anestesia dolorosa (0-2.5 %), y debilidad masticatoria (0-12 %) (90).
C) No invasiva y ablativa
Consisten en técnicas de radiocirugía estereotáctica con enfoque de radiación en zona de entrada de raíz trigeminal. Los métodos actuales son con Gamma Knife (GKS), acelerador lineal (LINAC) y CyberKnife RS (CKR). GKS usa inmovilización con marco estereotáctico y requiere colocarse tornillos bajo anestesia local, se emiten rayos gamma de cobalto-60 para tratamiento desde varios ángulos. Tratamiento LINAC puede realizarse con inmovilización con marco estereotáctico o de forma alternativa mascarilla facial, las fuentes de rayos X se mueven alrededor de la cabeza del paciente en arcos rotacionales y emite la dosis de radiación necesaria. El tratamiento de CKR requiere aplicación de mascarilla facial, en este caso la emisión de radiación se monta sobre brazo robótico y puede realizar movimientos no rotacionales alrededor de la cabeza del paciente.
Se consideran opciones cuando existe refractariedad en quienes no tienen conflicto neurovascular, o que no sea candidato a un procedimiento abierto, o por preferencia del paciente. El objetivo principal es atacar directamente nervio trigémino con alta precisión con radiación y efecto destructor en canales iónicos bloqueando la conducción en la estructura irradiada, en una sola sesión (112).
Las dosis medias máximas varían de 71.1 a 90.1 Grays (Gy) para GKS, 70 a 90 Gy para LINAC y 64.3 a 80.5 Gy para CKR. La respuesta libre de dolor con o sin ajuste de medicación se resume de la siguiente forma (rangos de media y mediana): GKS, 84.8 % y 85.6 % (66.6-100 %); LINAC, 87.3 % y 88.5 % (75-100 %); y CKR, 79.3 % y 79 % (50-100 %). La media y mediana de tasas de recurrencia fueron las siguientes: GKS, 24.6 % y 23 % (0-52.2 %); LINAC, 32.2 % y 29 % (19-63 %); CKR, 25.8 % y 27.2 % (15.8-33 %).
Los predictores positivos de respuesta son: edad avanzada, mayor a 70 años, dolor típico. Predictores negativos de respuesta son: esclerosis múltiple, cirugía previa, procedimientos de ablación, dolor atípico, menor a 70 años y diabetes mellitus (91).
La complicación más común es entumecimiento de cara en ramas sensitivas de nervio trigémino. Otras complicaciones incluyen: ojo seco, queratopatía neurotrófica, anestesia dolorosa, disminución reflejo corneal, debilidad masticación ipsilateral, trismus y disestesias.
Un estudio retrospectivo de Romanelli et al (92) analizó a 527 pacientes tratadas con GKS, en total se pudo realizar seguimiento a 36 meses de 387 pacientes. La tasa de alivio de dolor de estos pacientes a 6, 12, 18, 24, 30 y 36 meses respectivamente fue: 92 %, 87 %, 87 %, 82 %, 78 % y 76 %. De efectos adversos a 36 meses, 21 pacientes (6.1 %) reportaron hipoestesia facial.
Un estudio de cohorte prospectivo no aleatorizado comparó DMV y GKS, con 36 pacientes DMV y 44 pacientes GKS. Con seguimiento medio de 3.4 ± 2.14 años, tiempo completamente libre de dolor inicial y final fue de 100 % y 80.6 % en grupo DMV y 77.3 % y 45.5 % en grupo GKS. Se concluyó que la DMV es terapia quirúrgica de primera línea en adultos sanos y jóvenes y GKS debe realizarse en paciente mayores, con comorbilidades o que no aceptan intervención de DMV. (93)
Un estudio retrospectivo incluyó 126 pacientes sometidos a 153 intervenciones (33 DMV, 51 inyección glicerol y 69 radiocirugía), un mayor porcentaje de pacientes en los que se realizó DMV obtuvieron y mantuvieron desenlaces excelentes comparado con pacientes que se sometieron a inyección de glicerol o radiocirugía (78 % vs 55 % vs 52 %, respectivamente) (94).
Un estudio retrospectivo analizando CKR para NT refractario encontró que en 168 casos con dosis máxima mediana de 80 Grays se alcanzó adecuado alivio de dolor en 86.9 % de los casos, período de latencia mediana para efecto terapéutico de 35 días y duración de efecto terapéutico de 8.3 meses. El mantenimiento de alivio de dolor a 12, 36 y 60 meses fue de 77 %, 62.5 % y 50.2 %, respectivamente. (95)
Un estudio prospectivo por Zeng et al (96) evaluó desenlaces en pacientes que entraron a DMV y GKS para tratamiento definitivo de NT. Fueron inscritos 220 pacientes en grupo DMV y 221 en grupo GKS, ambas resultaron efectivas para tratar NT, aunque la tasa de alivio completo de dolor fue significativamente más alta en grupo DMV. No hubo diferencia significativa en recurrencia entre ambos grupos, sin embargo, hubo más complicaciones severas en grupo DMV que GKS.
El GKS al parecer también tiene utilidad como adyuvante para prolongar el tiempo libre de dolor en pacientes con NT con esclerosis múltiple, aunque controla dolor en el corto plazo al parecer no alcanza control a largo plazo. Un estudio retrospectivo de Franzini et al (97) analizó a 29 pacientes que entraron a procedimiento de GKS para NT. Tasas de reducción de dolor a 1, 3 y 5 años fue de 70 %, 57 % y 57 %, respectivamente.
Un estudio retrospectivo evaluando la efectividad en pacientes con esclerosis múltiple con NT observó una efectividad inicial de 88.2 % con una tasa de control adecuado de dolor a 1, 2 y 4 años de 54 %, 35 % y 24 %, respectivamente (98).
El GKS se ha demostrado como igual de efectivo que DMV en poblaciones de pacientes mayores de 80 años, en este grupo el GKS tiene alta tasa de seguridad, menos complicaciones y un efecto curativo positivo y eficiente (100).
Un estudio retrospectivo con 142 pacientes con NT tratados con GKS dio seguimiento hasta 37 meses. Posterior al tratamiento inicial, 93.7 % (133/142) de los pacientes experimentaron tratamiento exitoso. Hubo recurrencia de dolor en 50 pacientes (37.6 %, 50/133) y el tiempo mediano a recurrencia fue de 29 meses (2-166 meses, 42.26 ± 38.08 meses). Se reportaron complicaciones en 25 pacientes (17.6 %, 25/142) e incluyó hipoestesia facial en 19 pacientes (13.4 %), disestesia en 2 pacientes (1.4 %) y síndrome de ojo seco en 4 pacientes (2.8 %) (99).
Otro estudio retrospectivo de 108 pacientes con NT refractario a tratamiento médico entraron a GKS con desenlaces primarios siendo escala BNI y escalas de hipoestesia facial. A cuatro semanas, se observó alivio completo o adecuado (score BNI I a IIIB) en 86 de 108 pacientes (90 %). A 17 meses, 21 pacientes (26 %) reportaron recurrencia de dolor y 55 pacientes (55 %) reportaron nueva parestesia facial. Análisis multivariado encontró que un historial de dolor menor de 5 años era un predictor significativo de alivio de dolor (100).
Un estudio prospectivo comparó diferentes dosis de LINAC, concluyeron que dosis de 6 mm eran más efectivas que 5 mm (libre de dolor con dosis de 6 mm y 5 mm a 12 y 24 meses 90.2 % y 87.8 % versus 73.6 % y 73.6 %, respectivamente). Otra observación valiosa fue que a mayor dosis se presentaba mayores tasas de hipoestesia facial (101).
D) Otros
a. Talamotomía Central Lateral
Después de décadas de investigación, se aisló el núcleo central lateral (CLp) como meta para tratamiento en dolor neurogénico resistente a otros tratamientos. La talamotomía central lateral es una intervención quirúrgica contra dolor neurogénico donde se destruye el CLp, el cual está en posición de transferir vías espinotalámicas y espinoreticulotalámicas hasta la corteza cerebral (102).
El uso de ultrasonido enfocado de alta intensidad guiado por imagen de resonancia magnética (MRgFUS) ha influido en una gran reducción en morbilidad y aumenta la precisión comparada con otras técnicas. Es un procedimiento no invasivo con fines ablativos. Durante el procedimiento se fija la cabeza del paciente a un marco estereotáctico y se reconstruye con imagen por resonancia magnética. Una vez realizado el registro preoperatorio se procede con sonificación de alta poder al blanco terapéutico bajo guía con resonancia magnética, lo cual lleva a necrosis térmica coagulativa de células y ablación permanente (103).
Un estudio retrospectivo de Gallay et al. (102) con una cohorte de ocho pacientes encontró que esta intervención de forma bilateral se asoció con alivio del dolor en 51 % de pacientes a 3 meses, 71 % a un año y 78 % a seguimiento más reciente. Esto representa 63 % buenos resultados a 3 meses, 88 % a un año y 100 % en seguimiento más reciente. En seguimiento más reciente, los paroxismos de dolor seguían presentes en cinco pacientes (63 %) pero su intensidad media era de 27 ± 30 comparado con 70 ± 20 en escala visual análoga preoperatoria.
Un estudio retrospectivo analizó desenlaces de talamotomía mediante GKS en 30 pacientes con múltiples síndromes de dolor refractario, entre ellos NT. Se realizó una única dosis de 145 a 150 Gy a nivel de núcleos centromediano y parafasciculares talámicos. Se logró una tasa de éxito inicial de 43.3 % con disminución del dolor después de una latencia de 3 meses. Hubo recurrencia de dolor en 31 % de los pacientes que presentaron mejoría, no se observaron déficits neurológicos o complicaciones (104). Otro estudio similar con talamotomía mediante GKS en 21 pacientes encontró una reducción significativa de dolor en 12 pacientes (57 %) a 3 meses. Tasas de reducción de dolor a 1, 2, 3 y 5 años fue de 48 %, 48 %, 19 % y 19 %, respectivamente. Ningún paciente presentó eventos adversos relacionados (105).
b. Inyección Percutánea de Ozono alrededor del Ganglio Gasseriano
La terapia de oxígeno-ozono ha sido ampliamente recomendada para múltiples enfermedades, especialmente dolor neuropático como herniación discal lumbar y neuralgia post-herpética. Las ventajas de este tratamiento incluyen trauma mínimo, menos complicaciones y simplicidad.
Un estudio retrospectivo con 103 pacientes aplicó una mezcla de O₂-O₃ (3–5 ml) a una concentración de 30 μg/mL. Se concluyó que era un procedimiento seguro y efectivo con 88.35 % de alivio inicial de dolor (puntaje BNI ≤ IIIa). El alivio a 6 meses, 1 año y 2 años fue de 86.87 %, 84.46 % y 83.30 %, respectivamente. Se reportaron 3 casos de edema facial y un caso de dolor de raíz nerviosa, todos autolimitados (106).
c. Estimulación del Nervio Occipital (ENO)
Un estudio retrospectivo analizó resultados del tratamiento de NT refractaria con ENO, utilizando implantes subcutáneos colocados con técnica quirúrgica o percutánea. Se analizaron 7 pacientes, todos reportaron mejorías importantes con alivio del dolor media de 58 % a seguimiento a largo plazo. No se ha validado ENO para NT, pero es una opción de rescate para estos pacientes y hace falta realizar más estudios (107).
d. Estimulación de Médula Espinal Cervical
Consiste en la implantación de electrodos en el espacio peridural para manejo de dolor. Se teoriza que la estimulación causa liberación y modificación de neurotransmisores con incremento de GABA y serotonina y supresión de citocinas excitatorias.
Un estudio retrospectivo de Velázquez et al. (108) analizó a 12 pacientes con NT y seguimiento a 4.4 años. Tres pacientes no presentaron respuesta sostenida, mientras que los otros nueve alcanzaron reducción de dolor promedio de 57.1 %.
e. Estimulación de Nervio Periférico
Ofrece ventajas como bajo riesgo quirúrgico, reversibilidad, posibilidad de ajuste, y alteración de generadores centrales de dolor. El procedimiento consiste en colocar uno o más electrodos subcutáneamente sobre ramas del trigémino (supraorbitario, infraorbitario, mentoniano), conectados a un generador implantable.
En un estudio retrospectivo, 15 pacientes recibieron implante permanente. A 14 meses, 80 % seguía con el dispositivo activo y con reducción media de dolor de 52.3 %. Se reportaron buenos resultados funcionales y estéticos (109). En una serie de casos con 7 pacientes, 4 mantuvieron beneficio a 33 meses; 3 tuvieron recaídas después de una respuesta inicial (110).
f. Estimulación de Corteza Motora
Considerada técnica de neuromodulación de “rescate”. Se localiza el área dolorosa con resonancia magnética, se realiza craneotomía con neuronavegación y se colocan electrodos epidurales o subdurales conectados a un generador. Se cree que estimula circuitos inhibitorios corticocorticales, reduciendo la actividad nociceptiva.
En un estudio retrospectivo con 19 pacientes con NT, 68.4 % presentó una respuesta adecuada a 6 meses, con reducción de 3.6 puntos en EVA. Las complicaciones reportadas incluyen infección, hematoma, crisis epilépticas y efectos adversos cognitivos.
g. Estimulación de Nervio Transcutánea Eléctrica (TENS)
Involucra colocar electrodos en áreas inervadas por segundas y terceras ramas del nervio trigémino, donde se transmite corriente a través de la superficie de piel intacta para activar nervios subyacentes y aliviar el dolor.
Un estudio de 52 pacientes (ensayo clínico aleatorizado) comparó el efecto de TENS en pacientes con NT. Se encontró que el grupo tratado con TENS presentó una reducción en la dosis de carbamazepina en comparación con el grupo control; sin embargo, no hubo diferencia significativa en escalas visuales análogas ni en desenlace funcional entre ambos grupos (111).
Esta revisión muestra evidencia de que existen múltiples esquemas y líneas de tratamiento para NT. Existe mucha heterogeneidad en cuanto a los esquemas de tratamiento, así como respuesta dependiendo de la situación clínica. Esta revisión muestra evidencia de que el tratamiento farmacológico sigue siendo clave en el tratamiento inicial de esta patología. Las exacerbaciones del dolor agudo se autolimitan en la mayoría de los casos y no alcanzan a ser tratados por personal médico, aunque algunas presentaciones pueden presentar alta frecuencia de ataques y requerir tratamiento agudo abortivo. La mejor evidencia actual recomienda el uso de fenitoína intravenosa, lidocaína intravenosa y lidocaína en zonas gatillo. Una opción con pobre evidencia pero que al parecer es efectiva es lacosamida intravenosa.
La primera línea de tratamiento farmacológico recomendada por Academia Americana de Neurología es carbamazepina y oxcarbamazepina, proveen adecuado control inicial de dolor en hasta 90 % de los pacientes con reducción de intensidad y frecuencia de ataques con número requerido para tratar (NNT) de 1.8. La desventaja de estos fármacos son sus efectos adversos que causa suspensión de tratamiento en hasta 40 % de los pacientes. Ambos fármacos presentan múltiples interacciones farmacológicas, migrañas, mareo, náusea y vómito, depresión sistema nervioso central, hiponatremia. Está descrito, Síndrome Stevens-Johnson y Necrólisis Epidérmica Tóxica con el alelo HLA-B*1502, la cual ha resultado común en población China Han.
Se han descrito múltiples opciones como segunda línea de tratamiento en caso de pobre tolerancia a carbamazepina/oxcarbazepina o refractariedad al tratamiento. Los que tienen suficiencia evidencia para recomendarse en este contexto son: lamotrigina, gabapentina, pregabalina, baclofeno, fenitoína e inyecciones de botox. El tratamiento que ha tenido mayor auge en los últimos años es el uso de botox subcutánea, múltiples estudios han encontrado una efectividad mayor del 70 % con disminución significativa de dolor en escala visual análoga. Otros tratamientos disponibles (pero con pobre calidad de evidencia) incluyen lacosamida, vixotrigina, escarbazepina y Erunumab.
Por lo general, no existe consenso cuando debe de considerarse intervención quirúrgica. Se sugiere que por lo menos se utilice carbamazepina o oxcarbazepina y a considerar un fármaco de segunda línea, ambos a dosis máximas (con tolerancia de efectos adversos). La segunda línea terapéutica es quirúrgica y se reserva para paciente con dolor incontrolable tratado con fármacos o en aquellos que tienen efectos adversos relacionados a medicamentos. Las tres técnicas quirúrgicas principales son DMV, procedimientos percutáneos (microcompresión con balón), inyección glicerol, termocoagulación radiofrecuencia y radiocirugía estereotáctica.
A pesar del paso de los años el estándar de oro del tratamiento sigue siendo la DMV, es la intervención quirúrgica que mejores desenlaces presenta a mediano y largo plazo (aproximadamente 80-96 % de efectividad en posoperatorio). Se han descrito desenlaces tardíos libre de dolor de 70 %. Puede ser de utilidad en pacientes jóvenes y sin otras comorbilidades y debe de considerarse una opción limitada en la población geriátrica. Algunas complicaciones que presentan estos procedimientos incluyen: parálisis de pares craneales (4 %), hipoestesia facial (3 %), anacusia (1.8 %), edema/hemorragia/infarto cerebral (0.6 %), meningitis (0.4 %) y muerte (0.3 %). La tasa de complicaciones severas está calculada aproximadamente en 1.17 %. En manos expertas es la mejor opción para resolución de la enfermedad y presenta una tasa baja y aceptable de complicaciones.
Las técnicas ablativas percutáneas tienen su lugar en el abordaje terapéutico de esta enfermedad, especialmente en población geriátrica, pacientes con ausencia de contacto neurovascular (demostrado por estudios de imagen de alta calidad), con comorbilidades importantes que tolerarían pobremente intervención quirúrgica mayor. La técnica general de estos procedimientos consiste en inserción percutánea hacia la cueva de Meckel con denervación mediante distintas técnicas/mecanismos. Las diferentes técnicas presentan una efectividad inicial de alivio de dolor y son iguales de seguras. Puede haber diferencias en cuanto a tipo de procedimiento que se realice en qué clínica, tipo de proveedores y preferencias personales. Las opciones disponibles son ablación por radiofrecuencia, con balón o con glicerol. Otras técnicas ablativas (pero no invasivas) son con radioneurocirugía estereotáctica, entre estas opciones se encuentra GKA, LINAC y CKR. Se consideran opciones cuando existe refractariedad en quienes no tienen conflicto neurovascular, o que no sea candidato a un procedimiento abierto, o por preferencia del paciente. El objetivo principal es atacar directamente nervio trigémino con alta precisión con radiación y efecto destructor en canales iónicos bloqueando la conducción en la estructura irradiada, en una sola sesión. Las tasas de respuesta libre de dolor inicial son de aproximadamente 80 % entre las tres técnicas con una media de recurrencia aproximada de 25 %. A 36 meses, las tasas libres de dolor son aproximadamente 75 %. Es una excelente opción en poblaciones mayores de 80 años donde la GKS ha resultado igual de efectivo que la DMV y con alta tasa de seguridad, menos complicaciones y un efecto curativo positivo y eficiente.
Actualmente hay algunas técnicas que son consideradas de última línea y/o rescate ya que no se cuenta con un alto nivel de evidencia científica de calidad para recomendar su uso generalizado. La CLp, especialmente con abordajes mínimamente invasivos (MRgFUS), es un procedimiento no invasivo con fines ablativos. La mayoría de los estudios descritos son cohortes pequeñas y con resultados que no se observan a corto plazo. A 3 meses del procedimiento, se observó una reducción de dolor en 43-57 % de los pacientes y a 1 año se observó una reducción de dolor en 48-78 % de los pacientes. Otras intervenciones que tienen muy poca evidencia para su uso con inyección percutánea de ozono alrededor del Ganglio Gasseriano, Estimulación Nervio Occipital, Estimulación de Médula Espinal Cervical, Estimulación de Nervio Periférico, Estimulación de Corteza Motora y Estimulación de Nervio Transcutánea Eléctrica.
Referencias:
2. Lambru G, Zakrzewska J, Matharu M. Trigeminal neuralgia: A practical guide. Practical Neurology. 2021; 21(5):392–402. doi:10.1136/practneurol-2020-002782
3. Campbell WW, Barohn RJ, Col L, Ziegler D. DeJong’s The Neurologic Examination. 8th edition Wolters Kluwer; 2020.
4. Gambeta E, Chichorro JG, Zamponi GW. Trigeminal neuralgia: An overview from pathophysiology to pharmacological treatments. Molecular Pain. 2020;16. doi:10.1177/1744806920901890
5. Kress B, Schindler M, Rasche D, Hähnel S, Tronnier V, Sartor K. Trigeminal neuralgia: How often are trigeminal nerve vessel contacts found by MRI in normal volunteers? RöFo – Fortschritte auf dem Gebiet der Röntgenstrahlen und der bildgebenden Verfahren. 2006;178(03):313–5. doi:10.1055/s-2005-858959
6. Jannetta PJ. Arterial compression of the trigeminal nerve at the pons in patients with trigeminal neuralgia. Journal of Neurosurgery. 1967;26(1):159–162. doi:10.3171/jns.1967.26.1part2.0159
7. The International Classification of Headache Disorders, 3rd edition (beta version). Cephalalgia. 2013; 14;33(9):629–808. doi:10.1177/0333102413485658
8. Mueller D, Obermann M, Yoon M-S, Poitz F, Hansen N, Slomke M-A, et al. Prevalence of trigeminal neuralgia and persistent idiopathic facial pain: A population-based study. Cephalalgia. 2011; 29;31(15):1542–8. doi:10.1177/0333102411424619
9. Koopman JSHA, Dieleman JP, Huygen FJ, de Mos M, Martin CGM, Sturkenboom MCJM. Incidence of facial pain in the general population. Pain. 2009;147(1):122–7. doi:10.1016/j.pain.2009.08.023
10. Rappaport ZH, Govrin-Lippmann R, Devor M. An electron-microscopic analysis of biopsy samples of the trigeminal root taken during microvascular decompressive surgery. Stereotactic and Functional Neurosurgery. 1997;68(1–4):182–6. doi:10.1159/000099920
11. Devor M, Amir R, Rappaport ZH. Pathophysiology of trigeminal neuralgia: The ignition hypothesis. The Clinical Journal of Pain. 2002;18(1):4–13. doi:10.1097/00002508-200201000-00002
12. Peker S, Kurtkaya Ö, Üzün İ, Pamir MN. Microanatomy of the central myelin-peripheral myelin transition zone of the trigeminal nerve. Neurosurgery. 2006;59(2):354–9. doi:10.1227/01.neu.0000223501.27220.69
13. Marinković S, Todorović V, Gibo H, Budeč M, Drndarević N, Pešić D, et al. The trigeminal vasculature pathology in patients with neuralgia. Headache: The Journal of Head and Face Pain. 2007;47(9):1334–9. doi:10.1111/j.1526-4610.2007.00933.x
14. Peet MM, Schneider RC. Trigeminal neuralgia. Journal of Neurosurgery. 1952;9(4):367–77. doi:10.3171/jns.1952.9.4.0367
15. Maarbjerg S, Gozalov A, Olesen J, Bendtsen L. Trigeminal neuralgia – a prospective systematic study of clinical characteristics in 158 patients. Headache: The Journal of Head and Face Pain. 2014 18;54(10):1574–82. doi:10.1111/head.12441
16. Haviv Y, Khan J, Zini A, Almoznino G, Sharav Y, Benoliel R. Trigeminal neuralgia (part I): Revisiting the clinical phenotype. Cephalalgia. 2015 19;36(8):730–46. doi:10.1177/0333102415611405
17. Bendtsen L, Zakrzewska JM, Abbott J, Braschinsky M, Di Stefano G, Donnet A, et al. European Academy of Neurology guideline on trigeminal neuralgia. European Journal of Neurology. 2019; 8;26(6):831–49. doi:10.1111/ene.13950
18. Leclercq D, Thiebaut J-B, Héran F. Trigeminal neuralgia. Diagnostic and Interventional Imaging. 2013;94(10):993–1001. doi:10.1016/j.diii.2013.08.002
19. Bendtsen L, Zakrzewska JM, Heinskou TB, Hodaie M, Leal PR, Nurmikko T, et al. Advances in diagnosis, classification, pathophysiology, and management of trigeminal neuralgia. The Lancet Neurology. 2020;19(9):784–96. doi:10.1016/s1474-4422(20)30233-7
20. Cheshire WP. Trigeminal neuralgia. CNS Drugs. 1997;7(2):98–110. doi:10.2165/00023210-199707020-00002
21. Schnell S, Marrodan M, Acosta JN, Bonamico L, Goicochea MT. Trigeminal neuralgia crisis – intravenous phenytoin as acute rescue treatment. Headache: The Journal of Head and Face Pain. 2020; 27;60(10):2247–53. doi:10.1111/head.13963
22. Noro S, Seo Y, Honjo K, Okuma M, Asayama B, Amano Y, et al. Intravenous fosphenytoin therapy for rescue of acute trigeminal neuralgia crisis in patients awaiting neurosurgical procedures: A cross-sectional study. Journal of Clinical Neuroscience. 2021;94:59–64. doi:10.1016/j.jocn.2021.09.040
23. Mullins CF, Fuccaro M, Pang D, Min L, Andreou AP, Lambru G. A single infusion of intravenous lidocaine for primary headaches and trigeminal neuralgia: A retrospective analysis. Frontiers in Neurology. 2023; 10;14. doi:10.3389/fneur.2023.1202426
24. Chong MS, Bahra A, Zakrzewska JM. Guidelines for the management of trigeminal neuralgia. Cleveland Clinic Journal of Medicine. 2023;90(6):355–62. doi:10.3949/ccjm.90a.22052
25. Muñoz-Vendrell A, Teixidor S, Sala-Padró J, Campoy S, Huerta-Villanueva M. Intravenous lacosamide and phenytoin for the treatment of acute exacerbations of trigeminal neuralgia: A retrospective analysis of 144 cases. Cephalalgia. 2022; 26;42(10):1031–8. doi:10.1177/03331024221092435
26. Perloff MD, Chung JS. Urgent care peripheral nerve blocks for refractory trigeminal neuralgia. The American Journal of Emergency Medicine. 2018;36(11):2058–60. doi:10.1016/j.ajem.2018.08.019
27. Wiffen PJ, Derry S, Moore RA, McQuay HJ. Carbamazepine for acute and chronic pain in adults. Cochrane Database of Systematic Reviews. 2011; 19; doi:10.1002/14651858.cd005451.pub2
28. Araya EI, Claudino RF, Piovesan EJ, Chichorro JG. Trigeminal neuralgia: Basic and clinical aspects. Current Neuropharmacology. 2020; 23;18(2):109–19. doi:10.2174/1570159×17666191010094350
29. Zakrzewska JM, Ivanyi L. In vitro lymphocyte proliferation by carbamazepine, carbamazepine-10, 11-epoxide, and oxcarbazepine in the diagnosis of drug-induced hypersensitivity. Journal of Allergy and Clinical Immunology. 1988;82(1):110–5. doi:10.1016/0091-6749(88)90059-0
30. Mufson JM. Lamotrigine: Pharmacology, clinical utility, and new safety concerns. American Journal of Psychiatry Residents’ Journal. 2018; 1;13(12):2–4. doi:10.1176/appi.ajp-rj.2018.131201
31. Bendtsen L, Zakrzewska JM, Abbott J, Braschinsky M, Di Stefano G, Donnet A, et al. European Academy of Neurology guideline on trigeminal neuralgia. European Journal of Neurology. 2019;8;26(6):831–49. doi:10.1111/ene.13950
32. Sills G. The mechanisms of action of gabapentin and pregabalin. Current Opinion in Pharmacology. 2006;6(1):108–13. doi:10.1016/j.coph.2005.11.003
33. Alles SR, Smith PA. The anti-allodynic gabapentinoids. The Neuroscientist. 2016;8;23(1):40–55. doi:10.1177/1073858416628793
34. Kremer M, Salvat E, Muller A, Yalcin I, Barrot M. Antidepressants and gabapentinoids in neuropathic pain: Mechanistic insights. Neuroscience. 2016;338:183–206. doi:10.1016/j.neuroscience.2016.06.057
35. Bergouignan, M. Fifteen years of trial therapy of essential trigeminal neuralgia: The place of diphenylhydantoin and its derivatives. Rev. Neurol. 1958;98(5):414–416.
36. Gambeta E, Chichorro JG, Zamponi GW. Trigeminal neuralgia: An overview from pathophysiology to pharmacological treatments. Molecular Pain. 2020;16. doi:10.1177/1744806920901890
37. Moore D, Chong MS, Shetty A, Zakrzewska JM. A systematic review of rescue analgesic strategies in acute exacerbations of primary trigeminal neuralgia. British Journal of Anaesthesia. 2019;123(2). doi:10.1016/j.bja.2019.05.026
38. Lee JY, Lee GH, Yi SH, Sim WS, Kim BW, Park HJ. Non-surgical treatments of trigeminal neuralgia from the perspective of a pain physician: A narrative review. Biomedicines. 2023;21;11(8):2315. doi:10.3390/biomedicines11082315
39. Romito JW, Turner ER, Rosener JA, Coldiron L, Udipi A, Nohrn L, et al. Baclofen Therapeutics, toxicity, and withdrawal: A narrative review. SAGE Open Medicine. 2021;9. doi:10.1177/20503121211022197
40. Guo B-L, Zheng C-X, Sui B-D, Li Y-Q, Wang Y-Y, Yang Y-L. A closer look to botulinum neurotoxin type A-induced analgesia. Toxicon. 2013;71:134–9. doi:10.1016/j.toxicon.2013.05.011
41. Aoki KR. Evidence for antinociceptive activity of botulinum toxin type A in pain management. Headache: The Journal of Head and Face Pain. 2003;43(s1):9–15. doi:10.1046/j.1526-4610.43.7s.3.x
42. Wu C, Xie N, Lian Y, Xu H, Chen C, Zheng Y, et al. Central antinociceptive activity of peripherally applied botulinum toxin type A in lab rat model of trigeminal neuralgia. SpringerPlus. 2016;11;5(1). doi:10.1186/s40064-016-2071-2
43. Wu C-J, Lian Y-J, Zheng Y-K, Zhang H-F, Chen Y, Xie N-C, et al. Botulinum toxin type A for the treatment of trigeminal neuralgia: Results from a randomized, double-blind, placebo-controlled trial. Cephalalgia. 2012;32(6):443–50. doi:10.1177/0333102412441721
44. Liu J, Xu Y-Y, Zhang Q-L, Luo W-F. Efficacy and safety of botulinum toxin type A in treating patients of advanced age with idiopathic trigeminal neuralgia. Pain Research and Management. 2018;2018:1–5. doi:10.1155/2018/7365148
45. Zhang H, Lian Y, Xie N, Chen C, Zheng Y. Single-dose botulinum toxin type A compared with repeated-dose for treatment of trigeminal neuralgia: A pilot study. The Journal of Headache and Pain. 2017;10;18(1). doi:10.1186/s10194-017-0793-3
46. Zhang H, Lian Y, Xie N, Cheng X, Chen C, Xu H, et al. Factors affecting the therapeutic effect of botulinum toxin A on trigeminal neuralgia: A follow-up retrospective study of 152 patients. Experimental and Therapeutic Medicine. 2019;9; doi:10.3892/etm.2019.7988
47. Wu S, Lian Y, Zhang H, Chen Y, Wu C, Li S, et al. Botulinum toxin type A for refractory trigeminal neuralgia in older patients: A better therapeutic effect. Journal of Pain Research. 2019;Volume 12:2177–86. doi:10.2147/jpr.s205467
48. Asan F, Gündüz A, Tütüncü M, Uygunoğlu U, Savrun FK, Saip S, et al. Treatment of multiple sclerosis–related trigeminal neuralgia with Onabotulinumtoxina. Headache: The Journal of Head and Face Pain. 2022;62(10):1322–8. doi:10.1111/head.14414
49. Yang F, Lin Q, Dong L, Gao X, Zhang S. Efficacy of 8 different drug treatments for patients with trigeminal neuralgia. The Clinical Journal of Pain. 2018;34(7):685–90. doi:10.1097/ajp.0000000000000577
50. Muñoz‐Vendrell A, Tena‐Cucala R, Campoy S, García‐Parra B, Prat J, Martínez‐Yélamos S, et al. Oral lacosamide for the treatment of refractory trigeminal neuralgia: A retrospective analysis of 86 cases. Headache: The Journal of Head and Face Pain. 2023;63(4):559–64. doi:10.1111/head.14505
51. Kotecha M, Cheshire WP, Finnigan H, Giblin K, Naik H, Palmer J, et al. Design of phase 3 studies evaluating Vixotrigine for treatment of trigeminal neuralgia. Journal of Pain Research. 2020;13:1601–9. doi:10.2147/jpr.s247182
52. Sanchez‐Larsen A, Sopelana D, Diaz‐Maroto I, Perona Moratalla AB, Gracia‐Gil J, García‐Muñozguren S, et al. Assessment of efficacy and safety of eslicarbazepine acetate for the treatment of trigeminal neuralgia. European Journal of Pain. 2018;12;22(6):1080–7. doi:10.1002/ejp.1192
53. Parascandolo E, Levinson K, Rizzoli P, Sharon R. Efficacy of erenumab in the treatment of trigeminal neuralgia. Neurology Clinical Practice. 2021;11(3):227–31. doi:10.1212/cpj.0000000000001075
54. Tai AX, Nayar VV. Update on trigeminal neuralgia. Current Treatment Options in Neurology. 2019;31;21(9). doi:10.1007/s11940-019-0583-0
55. Pamir M, Peker S. Microvascular decompression for trigeminal neuralgia: A long-term follow-up study. Minimally Invasive Neurosurgery. 2006;49(6):342–6. doi:10.1055/s-2006-960487
56. Wei Y, Pu C, Li N, Cai Y, Shang H, Zhao W. Long-term therapeutic effect of microvascular decompression for trigeminal neuralgia: Kaplan-Meier Analysis in a consecutive series of 425 patients. Turkish Neurosurgery. 2016; doi:10.5137/1019-5149.jtn.18322-16.1
57. Park CK, Park BJ. Surgical treatment for trigeminal neuralgia. Journal of Korean Neurosurgical Society. 2022;1;65(5):615–21. doi:10.3340/jkns.2021.0265
58. Barker FG, Jannetta PJ, Bissonette DJ, Larkins MV, Jho HD. The long-term outcome of microvascular decompression for trigeminal neuralgia. New England Journal of Medicine. 1996;25;334(17):1077–84. doi:10.1056/nejm199604253341701
59. Cote DJ, Dasenbrock HH, Gormley WB, Smith TR, Dunn IF. Adverse events after microvascular decompression: A National Surgical Quality Improvement Program analysis. World Neurosurgery. 2019;128. doi:10.1016/j.wneu.2019.05.022
60. Yue Y, Zhao Z-R, Liu D-C, Liu H-J, Lu D-L, Zhang H, et al. Life-threatening complications after microvascular decompression procedure: Lessons from a consecutive series of 596 patients. Journal of Clinical Neuroscience. 2021;86:64–70. doi:10.1016/j.jocn.2021.01.014
61. Mizobuchi Y, Nagahiro S, Kondo A, Arita K, Date I, Fujii Y, et al. Microvascular decompression for trigeminal neuralgia: A prospective, multicenter study. Neurosurgery. 2021;29;89(4):557–64. doi:10.1093/neuros/nyab229
62. Chen F, Niu Y, Meng F, Xu P, Zhang C, Xue Y, et al. Recurrence rates after microvascular decompression in patients with primary trigeminal neuralgia and its influencing factors: A systematic review and meta-analysis based on 8,172 surgery patients. Frontiers in Neurology. 2021;30;12. doi:10.3389/fneur.2021.738032
63. Li L, Seaman SC, Bathla G, Smith MC, Dundar B, Noeller J, et al. Microvascular decompression versus stereotactic radiosurgery for trigeminal neuralgia: A single-institution experience. World Neurosurgery. 2020;143. doi:10.1016/j.wneu.2020.07.161
64. Wu M, Jiang X, Niu C, Fu X. Outcome of internal neurolysis for trigeminal neuralgia without neurovascular compression and its relationship with intraoperative trigeminocardiac reflex. Stereotactic and Functional Neurosurgery. 2018;96(5):305–10. doi:10.1159/000493547
65. Durnford AJ, Gaastra B, Akarca D, Lodge A, Ewbank FG, Noorani I, et al. Internal neurolysis: ‘nerve combing’ for trigeminal neuralgia without neurovascular conflict – early UK outcomes. British Journal of Neurosurgery. 2020;10;36(2):175–8. doi:10.1080/02688697.2020.1837730
66. Sabourin V, Mazza J, Garzon T, Head J, Ye D, Stefanelli A, et al. Internal neurolysis with and without microvascular decompression for trigeminal neuralgia: Case series. World Neurosurgery. 2020;143. doi:10.1016/j.wneu.2020.06.206
67. Eide PK, Stubhaug A. Relief of trigeminal neuralgia after percutaneous retrogasserian glycerol rhizolysis is dependent on normalization of abnormal temporal summation of pain, without general impairment of sensory perception. Neurosurgery. 1998;43(3):462–72. doi:10.1097/00006123-199809000-00036
68. Mullan S, Lichtor T. Percutaneous microcompression of the trigeminal ganglion for trigeminal neuralgia. Journal of Neurosurgery. 1983;59(6):1007–12. doi:10.3171/jns.1983.59.6.1007
69. Xu R, Xie ME, Jackson CM. Trigeminal neuralgia: Current approaches and emerging interventions. Journal of Pain Research. 2021;14:3437–63. doi:10.2147/jpr.s331036
70. Xia Y, Yu G, Min F, Xiang H, Huang J, Leng J. The focus and new progress of percutaneous balloon compression for the treatment of trigeminal neuralgia. Journal of Pain Research. 2022;15:3059–68. doi:10.2147/jpr.s374433
71. Deng S, Luo J, Lai M, Yang W, Feng W, Ouyang J, et al. Percutaneous balloon compression for trigeminal neuralgia: Experience and surgical techniques from a single institution. Acta Neurologica Belgica. 2023;23;123(6):2295–302. doi:10.1007/s13760-023-02310-1
72. Li Z, Xie Z, Tang G, Jin S. Comparison of percutaneous balloon compression and microvascular decompression in the treatment of trigeminal neuralgia. Pakistan Journal of Medical Sciences. 2023;10;39(5). doi:10.12669/pjms.39.5.8049
73. Noorani I, Lodge A, Durnford A, Vajramani G, Sparrow O. Comparison of first-time microvascular decompression with percutaneous surgery for trigeminal neuralgia: Long-term outcomes and prognostic factors. Acta Neurochirurgica. 2021;22;163(6):1623–34. doi:10.1007/s00701-021-04793-4
74. Dong F, Zhan Q, Shao Z, Gu Q, Gao X, Zhou B, et al. Clinical study on the treatment of primary trigeminal neuralgia by robot-assisted percutaneous balloon compression. Frontiers in Surgery. 2022;12;9. doi:10.3389/fsurg.2022.1007818
75. Wu H, Zhou J, Chen J, Gu Y, Shi L, Ni H. Therapeutic efficacy and safety of radiofrequency ablation for the treatment of trigeminal neuralgia: A systematic review and meta-analysis. Journal of Pain Research. 2019;12:423–41. doi:10.2147/jpr.s176960
76. Gunduz HB, Cevik OM, Asilturk M, Gunes M, Uysal ML, Sofuoglu OE, et al. Percutaneous radiofrequency thermocoagulation in trigeminal neuralgia: Analysis of early and late outcomes of 156 cases and 209 interventions. Journal of Korean Neurosurgical Society. 2021;1;64(5):827–36. doi:10.3340/jkns.2020.0333
77. Xu R, Xie ME, Jackson CM. Trigeminal neuralgia: Current approaches and emerging interventions. Journal of Pain Research. 2021;14:3437–63. doi:10.2147/jpr.s331036
78. Wang Z, Wang Z, Li K, Su X, Du C, Tian Y. Radiofrequency thermocoagulation for the treatment of trigeminal neuralgia. Experimental and Therapeutic Medicine. 2021;30;23(1). doi:10.3892/etm.2021.10939
79. Mansano AM, Frederico TN, Valentin RE, Carmona MJ, Ashmawi HA. Percutaneous radiofrequency ablation for trigeminal neuralgia management: A randomized, double-blinded, sham-controlled clinical trial. Pain Medicine. 2022;27;24(3):234–43. doi:10.1093/pm/pnac132
80. Orhurhu V, Khan F, Quispe RC, et al. Use of radiofrequency ablation for the management of facial pain: a systematic review. Pain Physician. 2020;23\:E559–80.
81. Zheng S, Li X, Li R, Yang L, He L, Cao G, et al. Factors associated with long-term risk of recurrence after percutaneous radiofrequency thermocoagulation of the gasserian ganglion for patients with trigeminal neuralgia. The Clinical Journal of Pain. 2019;4;35(12):958–66. doi:10.1097/ajp.0000000000000758
82. Herta J, Loidl TB, Schmied T, Tomschik M, Khalaveh F, Wang W-T, et al. Retrospective comparison of percutaneous balloon compression and radiofrequency thermocoagulation in the management of trigeminal neuralgia. Acta Neurochirurgica. 2023;7. doi:10.1007/s00701-023-05656-w
83. Jefferson A. Trigeminal root and ganglion injections using phenol in glycerine for the relief of trigeminal neuralgia. Journal of Neurology, Neurosurgery & Psychiatry. 1963;1;26(4):345–52. doi:10.1136/jnnp.26.4.345
84. Wilkinson HA. Trigeminal nerve peripheral branch phenol/glycerol injections for TIC Douloureux. Journal of Neurosurgery. 1999;90(5):828–32. doi:10.3171/jns.1999.90.5.0828
85. Cheng JS, Lim DA, Chang EF, Barbaro NM. A review of percutaneous treatments for trigeminal neuralgia. Operative Neurosurgery. 2014;10(1):25–33. doi:10.1227/neu.00000000000001687
86. Chang KW, Jung HH, Chang JW. Percutaneous procedures for trigeminal neuralgia. Journal of Korean Neurosurgical Society. 2022;1;65(5):622–32. doi:10.3340/jkns.2022.0074
87. Paranathala MP, Ferguson L, Bowers R, Mukerji N. Percutaneous retrogasserian glycerol rhizotomy for trigeminal neuralgia: An alternative technique. British Journal of Neurosurgery. 2018;8;32(6):657–60. doi:10.1080/02688697.2018.1504882
88. Bethamcharla R, Abou‐Al‐Shaar H, Maarbjerg S, Chang Y, Gacka CN, Sekula RF. Percutaneous glycerol rhizolysis of the trigeminal ganglion for the treatment of idiopathic and classic trigeminal neuralgia: Outcomes and complications. European Journal of Neurology. 2023;18;30(10):3307–13. doi:10.1111/ene.15977
89. Goel A, Kulkarni G, Cotici A, Paluzzi A, Hayton T, Chelvarajah R. Volume maximised glycerol rhizolysis for trigeminal neuralgia: A Single Centre analysis of outcomes. British Journal of Neurosurgery. 2023;5:1–6. doi:10.1080/02688697.2023.2207657
90. Cheng JS, Lim DA, Chang EF, Barbaro NM. A review of percutaneous treatments for trigeminal neuralgia. Operative Neurosurgery. 2014;10(1):25–33. doi:10.1227/neu.00000000000001687
91. Tuleasca C, Régis J, Sahgal A, De Salles A, Hayashi M, Ma L, et al. Stereotactic radiosurgery for trigeminal neuralgia: A systematic review. Journal of Neurosurgery. 2019;130(3):733–57. doi:10.3171/2017.9.jns17545
92. Romanelli P, Conti A, Redaelli I, Martinotti AS, Bergantin A, Bianchi LC, et al. CyberKnife radiosurgery for trigeminal neuralgia. Cureus. 2019;28. doi:10.7759/cureus.6014
93. Linskey ME, Ratanatharathorn V, Peñagaricano J. A prospective Cohort Study of microvascular decompression and Gamma knife surgery in patients with trigeminal neuralgia. Journal of Neurosurgery. 2008;109(Supplement):160–72. doi:10.3171/jns/2008/109/12/s25
94. Pollock BE, Ecker RD. A prospective cost-effectiveness study of trigeminal neuralgia surgery. The Clinical Journal of Pain. 2005;21(4):317–22. doi:10.1097/01.ajp.0000125267.40304.57
95. Guillemette A, Heymann S, Roberge D, Ménard C, Fournier-Gosselin M-P. CyberKnife radiosurgery for trigeminal neuralgia: A retrospective review of 168 cases. Neurosurgical Focus. 2022;53(5). doi:10.3171/2022.8.focus22370
96. Zeng YJ, Zhang H, Yu S, Zhang W, Sun XC. Efficacy and safety of microvascular decompression and Gamma Knife Surgery treatments for patients with primary trigeminal neuralgia: A prospective study. World Neurosurgery. 2018;116. doi:10.1016/j.wneu.2018.04.120
97. Franzini A, Tropeano MP, Olei S, De Robertis M, Rossini Z, Attuati L, et al. Gamma knife radiosurgery for the treatment of trigeminal neuralgia in patients with multiple sclerosis: A Single-Center Retrospective Study and Literature Review. World Neurosurgery. 2021;149. doi:10.1016/j.wneu.2021.02.074
98. Xu Z, Mathieu D, Heroux F, Abbassy M, Barnett G, Mohammadi AM, et al. Stereotactic radiosurgery for trigeminal neuralgia in patients with multiple sclerosis: A multicenter study. Neurosurgery. 2018;23;84(2):499–505. doi:10.1093/neuros/nyy142
99. Park SH, Chang JW. Gamma knife radiosurgery on the trigeminal root entry zone for idiopathic trigeminal neuralgia: Results and a review of the literature. Yonsei Medical Journal. 2020;61(2):111. doi:10.3349/ymj.2020.61.2.111
100. Lee C-C, Chen C-J, Chong ST, Hung S-C, Yang H-C, Lin CJ, et al. Early stereotactic radiosurgery for medically refractory trigeminal neuralgia. World Neurosurgery. 2018;112. doi:10.1016/j.wneu.2018.01.088
101. Ortholan C, Colin P, Serrano B, Bouet T, Garnier N, le Guyader M, et al. Radiosurgery for classical trigeminal neuralgia: Impact of the shot size on clinical outcome. The Journal of Headache and Pain. 2023;11;24(1). doi:10.1186/s10194-023-01583-4
102. Gallay MN, Moser D, Jeanmonod D. MR-guided focused ultrasound central lateral thalamotomy for trigeminal neuralgia: Single center experience. Frontiers in Neurology. 2020;17;11. doi:10.3389/fneur.2020.00271
103. Taranta V, Saporito G, Ornello R, Splendiani A, Bruno F, Sucapane P, et al. Magnetic resonance-guided focused ultrasound thalamotomy for refractory neuropathic pain: A systematic review and critical appraisal of current knowledge. Therapeutic Advances in Neurological Disorders. 2023;16. doi:10.1177/17562864231180729
104. Urgosik D, Liscak R. Medial gamma knife thalamotomy for intractable pain. Journal of Neurosurgery. 2018;129(Suppl1):72–6. doi:10.3171/2018.7.gks181583
105. Franzini A, Ninatti G, Rossini Z, Tropeano MP, Clerici E, Navarria P, et al. Gamma knife central lateral thalamotomy for chronic neuropathic pain: A single-center, retrospective study. Neurosurgery. 2022;10;92(2):363–9. doi:10.1227/neu.0000000000002211
106. Gao L, Chen R-W, Williams JP, Li T, Han W-J, Zhao Q-N, et al. Efficacy and safety of percutaneous ozone injection around gasserian ganglion for the treatment of trigeminal neuralgia: A Multicenter retrospective study. Journal of Pain Research. 2020;13:927–36. doi:10.2147/jpr.s232081
107. Balossier A, Donnet A, Régis J, Leplus A, Lantéri-Minet M, Fontaine D. Occipital nerve stimulation for recurrent trigeminal neuralgia without occipital pain. Neuromodulation: Technology at the Neural Interface. 2023;26(8):1795–801. doi:10.1016/j.neurom.2022.03.012
108. Velásquez C, Tambirajoo K, Franceschini P, Eldridge PR, Farah JO. Upper cervical spinal cord stimulation as an alternative treatment in trigeminal neuropathy. World Neurosurgery. 2018;114. doi:10.1016/j.wneu.2018.03.044
109. Bina RW, Palsma RS, Weinand ME, Kasoff WS. Peripheral nerve stimulation for refractory trigeminal pain: Recent single-institution case series with long-term follow-up and review of the literature. Neuromodulation: Technology at the Neural Interface. 2020;23(6):796–804. doi:10.1111/ner.13132
110. Aibar-Durán JÁ, Villalba Martínez G, Freixer-Palau B, Araus-Galdós E, Morollón Sanchez-Mateos N, Belvis Nieto R, et al. Long-term results of cortical motor stimulation for neuropathic peripheral and central pain: Real-world evidence from two independent centers. Neurosurgery. 2023;28. doi:10.1227/neu.0000000000002638
111. Bisla S, Gupta A, Agarwal S, Singh H, Sehrawat A, Singh A. Evaluation of transcutaneous electrical nerve stimulation as an adjunct therapy in trigeminal neuralgia – a randomized double-blind placebo-controlled clinical study. Journal of Dental Anesthesia and Pain Medicine. 2021;21(6):565. doi:10.17245/jdapm.2021.21.6.565
112. Rogers CL, Shetter AG, Fiedler JA, Smith KA, Han PP, Speiser BL. Gamma knife radiosurgery for trigeminal neuralgia: The initial experience of the Barrow Neurological Institute. International Journal of Radiation Oncology*Biology*Physics. 2000;47(4):1013–9. doi:10.1016/s0360-3016(00)00513-7
113. Yu R, Wang C, Qu C, Jiang J, Meng Q, Wang J, et al. Study on the therapeutic effects of trigeminal neuralgia with microvascular decompression and Stereotactic Gamma Knife Surgery in the elderly. Journal of Craniofacial Surgery. 2019;30(1). doi:10.1097/scs.0000000000004999
114. Klein J, Siepmann T, Schackert G, Ziemssen T, Juratli TA. Peripheral nerve field stimulation in medically refractory trigeminal neuralgia attributed to multiple sclerosis. Journal of Neurosurgery. 2021;134(4):1244–50. doi:10.3171/2019.12.jns192261
