Apartados
Resumen
Abstract
Introducción
Discusión
Referencias
1Yudy Andrea Chicaiza-Guerrero*, 2Alonso Presno-Rivas, 1Silvia Yessenia Campoverde-Ramírez.
Dirección Oropesa 7A Canto Galicia, residencial tres cantos Cuautlancingo, Puebla C.P. 72700
1Médico Residente de la especialidad de Anestesiología, Hospital General de Puebla “Dr. Eduardo Vázquez N.” 2 Médico
Anestesiólogo Adscrito al Hospital General de Puebla “Dr. Eduardo Vázquez N.” Puebla, México.
Anestesia en México 2025;37(2): 154-158 https://doi.org/10.64221/aem-37-2-2025-012
Fecha de recepción enero 2025, Fecha de revisión febrero 2025, fecha de publicación marzo 2025. yachg001@hotmail.com
Palabras claves. Feocromocitoma, crisis hipertensiva, manejo anestésico, catecolaminas.
Abstract
Keyword
Pheochromocytoma, hypertensive crisis, anesthetic management, catecholamines.
Introducción
Las manifestaciones clínicas son producto de la secreción excesiva de catecolaminas y su presentación clínica varía ampliamente, se le conoce como “el gran imitador”. Pueden presentarse como crisis paroxísticas de 15-60 minutos de duración y resolución lenta; la triada clásica consiste en cefalea (80 %), palpitaciones (64 %) y diaforesis (57 %) acompañado de hipertensión arterial (85 %). La hipertensión puede ser mantenida o paroxística acompañada de dolor abdominal, vómitos, dolor torácico, taquicardia, nerviosismo, irritabilidad, pérdida de peso, temblor de manos, palidez, frialdad y diaforesis, aumento de la temperatura y flushing.
El diagnóstico debe establecerse bioquímicamente mediante la determinación de metanefrinas plasmáticas y/o urinarias; el estudio radiológico para localización debe basarse en la realización de TAC o resonancia magnética (RM). Aproximadamente entre el 9 y el 23 % de los tumores son extraadrenales, pero el 95 % se localiza en el abdomen y la pelvis. El tratamiento de elección es la cirugía por vía laparoscópica en tumores menores de 8 cm, ya que ofrece varias ventajas respecto a la cirugía convencional. (9,10).
Mujer de 51 años con antecedente de mastectomía izquierda con hallazgos en ultrasonido abdominal de imagen en topografía de glándula suprarrenal derecha; por lo que se solicitó TAC de abdomen reportando proceso neoplásico en glándula suprarrenal derecha de 40 x 37 mm, sin sintomatología asociada; por hallazgos imagenológicos se programó para adrenalectomía derecha laparoscópica. Tiene antecedentes de hipertensión arterial crónica en manejo con captopril 25 mg vía oral, cáncer de mama izquierda con requerimiento de mastectomía radical y 8 sesiones de quimioterapia a base de docetaxel y ciclofosfamida; quirúrgicos: 3 cesáreas con anestesia regional y mastectomía bajo anestesia general sin complicaciones.
Al examen físico con signos vitales: tensión arterial 126/89 mm Hg, frecuencia cardiaca: 95 latidos/min, frecuencia respiratoria: 15 respiraciones/min, temperatura: 36 grados centígrados, saturación de oxígeno: 92 % con FIO2 0.21; 53 Kg de peso, estatura 1.47 metros, presencia de manchas color café con leche y schwannomas en región facial y dorsal, adoncia parcial, Mallampati clase II, Patil Aldrete: II, distancia esternomentoniana: II, Bell House Dore: II, asimetría torácica por mastectomía izquierda; resto de examen físico sin alteraciones.
Laboratorios: Biometría hemática: Leucocitos: 6.53 10³/ul, Neutrófilos: 76.20 %, Hemoglobina: 13.6 g/dl, Hematocrito: 42.4 %, volumen corpuscular medio: 87.4 ft, Plaquetas: 341 10³/ul; Tiempos de coagulación: Tiempo de protrombina: 10.7 s, INR: 0.94 s, TTPa: 29.7 s, % actividad: 111 %, Fibrinógeno: 493 mg/dl; Química sanguínea: Glucosa: 69 mg/dL, Nitrógeno ureico: 13.2 mg/dL, Urea: 28.11 mg/dL, Creatinina: 0.46 mg/dL, BT: 0.62 mg/dL, BD: 0.29 mg/dL, BI: 0.33 mg/dL, Ácido úrico: 3.2 mg/dL, Proteínas totales: 6.6 g/dL, Albúmina: 4.16 g/dL; hormonales: cortisol: 15.1 ug/dL, aldosterona: 9.89 ug/dL, Catecolaminas: 392.4 ug/dL, calcio: 8.1 mg/dL, fosforo: 3.6 mg/dL, cloro: 106 mmol/L, potasio: 4.0 mmol/L, sodio: 143 mmol/L, AST: 25.1 UI/L, DHL: 283.6 UI/L.
El Ultrasonido abdominal evidenció imagen en topografía de glándula suprarrenal que sugiere adenoma; la TAC reportó proceso neoplásico en glándula suprarrenal derecha de 40 x 37 mm, ECG con hipertrofia ventricular izquierda. RX de tórax normal.
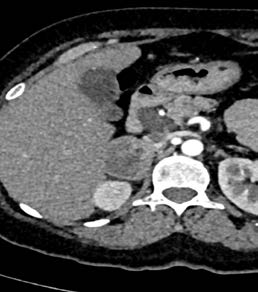
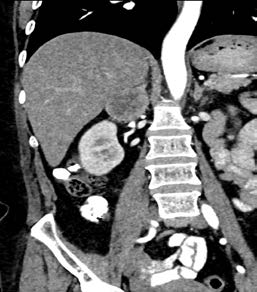
Figura 1. TAC. de abdomen. a) corte axial, b) corte coronal.
Masa heterogénea a nivel de glándula suprarrenal derecha
Paciente se clasificó como riesgo anestésico ASA II, riesgo de tromboembolismo Caprini: muy alto, riesgo cardiovascular LEE: II y riesgo respiratorio Ariscat: intermedio. Se calcula sangrado permisible (hematocrito de 30 %): 1033 mL. Plan anestésico: anestesia general,
ayuno de ocho horas, monitoria invasiva, reserva de tres unidades de glóbulos rojos y tres plasmas frescos congelados.
Se medicó en la Unidad de recuperación postanestésica (URPA) con dexmedetomidina a 1 μg/kg (53 μg), ceftriaxona un gramo intravenoso (iv), ketorolaco 50 mg iv, dexametasona 8 mg iv; monitorización tipo II con electrocardiograma, pulsioximetría, termómetro esofágico, línea arterial radial izquierda, catéter venoso yugular interno derecho, sonda vesical.
Signos vitales iniciales: tensión arterial: 130/62 mm Hg, frecuencia cardiaca: 84 lat/min, frecuencia respiratoria: 18 resp/min y saturación de oxígeno: 94 % con FIO2 0.21.
Se instaló catéter epidural a nivel de T9 – T10 sin complicaciones; inducción anestésica con fentanilo 250 μg iv, lidocaína 50 mg iv, propofol 60 mg iv y rocuronio 35 mg iv; se aseguró vía aérea con tubo traqueal 7.5.
Mantenimiento anestésico: sevoflurano 2,5 – 3 vol. % (CAM 0.8-0.9), lidocaína en infusión: 2 mg/kg/hora, sulfato de magnesio: 2 g en 20 minutos e infusión 15 mg/kg/hora, fentanilo: 2-4 μg/kg/hora, dexmedetomidina: 1 μg/kg/hora.
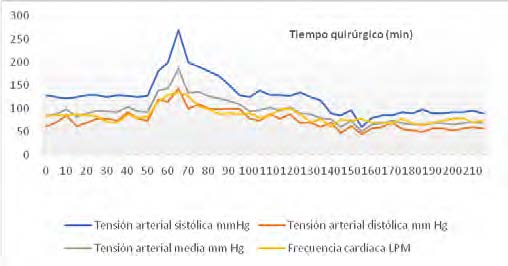
Durante el neumoperitoneo y manipulación de la lesión quirúrgica, la paciente presentó crisis hipertensiva y taquicardia con tensión arterial media (TAM) máxima de 185 mm Hg y FC 135 lat/min. Se requirió nitroprusiato en infusión: 4 μg/kg/min y esmolol: bolo de 25 mg + infusión 50 – 300 μg/kg/min.
Posterior a la ligadura de la vena suprarrenal derecha, TAM descendió a 50 mm Hg, manejada con norepinefrina: 0.05 – 0.1 μg/kg/min.(grafica 1).
Grafica 1. Comportamiento hemodinámico transquirúrgico.
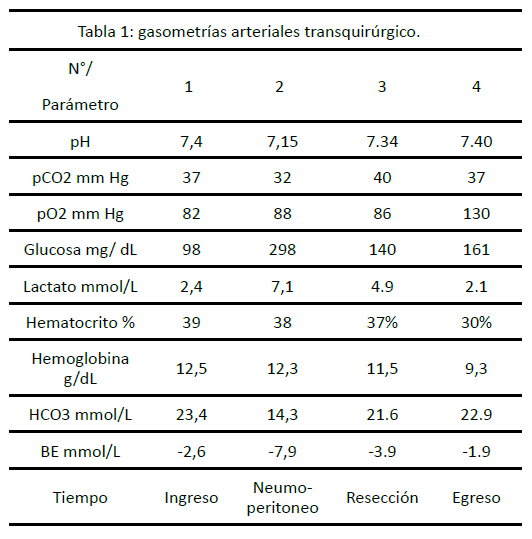
Durante crisis hipertensiva presentó acidosis metabólica,
hiperlactatemia e hiperglucemia administrándose bicarbonato
de sodio 53.4 mEq e insulina cristalina 8 UI IV (tabla I).
Tiempo quirúrgico: 2.5 horas. Tiempo anestésico: 3.5 horas.
Sangrado: 100 mL. Sin transfusión.
Líquidos: Hartmann 2500 mL. Diuresis: 1 mL/kg/hora.
Al final: ondansetrón 8 mg iv y buprenorfina 100 μg iv.
Extubación sin complicaciones.
Egreso a URPA: EVA 0, Aldrete 10, RAMSAY 2. Soporte vasopresor: norepinefrina 0.03 μg/kg/min.
Figura 2. Glándula suprarrenal derecha resecada
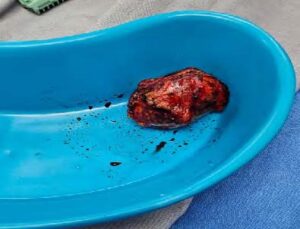
En el posquirúrgico inmediato (3 horas), sangrado activo por Penrose → reintervenido: laparotomía exploratoria con control de hemorragia en espacio de Morrison.
Egreso a URPA sin vasopresores.
Traslado a hospitalización sin requerir analgesia epidural. EVA 2/10.
Egreso a los 3 días con enalapril 25 mg c/24h.
Estudio histopatológico: feocromocitoma moderadamente diferenciado.
En nuestro caso el reporte de catecolaminas séricas y cifras tensionales dentro de parámetros normales descartó el diagnostico de feocromocitoma inicialmente, sin embargo, por el comportamiento de esta lesión durante el transoperatorio se sospechó feocromocitoma el cual se corroboró con el estudio histopatológico. El feocromocitoma se asocia a enfermedades genéticas, en el caso la paciente presenta hallazgos sugestivos de neurofibromatosis tipo 1, la cual incrementaba la sospecha diagnóstica (6,7).
La optimización farmacológica mejora la inestabilidad hemodinámica perioperatoria, la morbilidad y mortalidad postoperatoria, se inicia manejo con antagonistas alfa adrenérgicos no selectivos (fenoxibenzamina) o antagonistas alfa-adrenérgicos selectivos (prazosina, terazocina, doxazocina), el bloqueo betaadrenérgico se inicia posterior a cumplimiento de los criterios de Roizen para evaluar el adecuado bloqueo alfa adrenérgico y se realiza con atenolol, propanolol o metoprolol (2,12,13,14); los pacientes sin respuesta a las maniobras terapéuticas previas se les administra alfa-metil-tirosina la cual inhibe directamente la síntesis de catecolaminas (9).
El tratamiento definitivo es la resección quirúrgica, la cual se puede realizar por vía laparoscópica por abordaje retroperitoneal o transperitoneal y la técnica abierta (15). Se prefiere anestesia combinada con la inserción de catéter epidural T10-L1, monitorización invasiva y catéteres periféricos de gran calibre; la terapia ansiolítica con benzodiazepinas se recomienda para disminuir la descarga de catecolaminas (16); el sevoflurano e isoflurano son los gases anestésicos ideales por su potencial menos arritmogénico y estabilidad hemodinámica, el bloqueador neuromuscular ideal es el vecuronio ya que no libera histamina ni tiene propiedades autonómicas (2,9).
Durante el transoperatorio los puntos críticos asociados a crisis hipertensivas son: intubación traqueal, insuflación neumoperitoneo y manipulación quirúrgica de la glándula suprarrenal (17); en el caso se evidencian 2 etapas una de hipertensión severa y otra de hipotensión como lo reporta la literatura. El Consenso Italiano de Endocrinología recomienda el uso de moduladores del óxido nítrico para el manejo de crisis hipertensiva; como primera opción nitroprusiato de sodio seguido de nitroglicerina, como tercera opción dexmedetomidina a 1 ug/kg y sulfato de magnesio con dosis inicial de 3 gramos en bolo (9). El esmolol es el antagonista betaadrenérgico de elección con un bolo inicial y posterior infusión continua, también se recomienda la lidocaína a 1 mg/kg; los episodios de hipotensión severa se manejan inicialmente con fluidos por la depleción volumétrica y con agonista alfa adrenérgicos (norepinefrina) (9).
El caso presentado resulta de interés puesto que el objetivo del manejo anestésico es el adecuado control hemodinámico pre y transoperatorio, el uso de antagonistas alfa adrenérgicos no selectivos es el tratamiento de elección en el preoperatorio, en nuestro caso no se administró puesto que las cifras tensionales y los niveles de catecolaminas se reportaron dentro de parámetros normales, sin embargo, durante la insuflación de neumoperitoneo y manipulación quirúrgica presentó crisis hipertensiva con requerimiento de vasodilatador arterial y beta bloqueador selectivo logrando un control hemodinámico adecuado. Es indispensable la comunicación entre el anestesiólogo y cirujano para obtener un resultado exitoso.
Referencias:
2. Mora SV. El desafío hemodinámico: feocromocitoma y manejo anestésico. Rev. Medica Sinerg 2020;5(3): e393. doi.org/10.31434/rms.v5i3.393
3. Pierini A, Ruiz G, Rhys BE, Mar AS, Meneghini R. Paraganglioma latero aórtico. Rev. Argent Cir. 2023;115(3):282-286. doi.org/10.25132/raac.v115.n3.1636
4. Rípodas B, Arillo A, Murie M, García D. Feocromocitoma: Informe de un caso. An Sist Sanit Navar. 2012;35(1):121–5. DOI: [https://dx.doi.org/10.4321/S1137-66272012000100011](https://dx.doi.org/10.4321/S1137-66272012000100011)
5. Oleaga A, Goñi F. Feocromocitoma: actualización diagnóstica y terapéutica. Endocrinol Nutr. 2008;55(5):202–16. doi:10.1016/S1575-0922(08)70669-7
6. Vieites A, Sanso G, Bergada I. Feocromocitoma: nuevas perspectivas en diagnóstico y seguimiento. Rev. Hosp. Niños (B. Aires) 2018;60(270):278-283. [http://hdl.handle.net/11336/91343](http://hdl.handle.net/11336/91343)
7. Castillo SM, De la Fuente PC, Moranchel GL. Feocromocitoma como causa secundaria de hipertensión. Aten Fam. 2019;26(3):109. doi.org/10.22201/facmed.14058871p.2019.3.70038
8. Sbardella E, Grossman AB. Pheochromocytoma: an approach to diagnosis. Best Pract Res Clin Endocrinol Metab. 2020;34(2). doi.org/10.1016/j.beem.2019.101346
9. Araujo CM, Pascual CE, Nattero CL, Martínez LA, Gordoa A, et al. Protocol for presurgical and anesthetic management of pheochromocytomas and sympathetic paragangliomas: a multidisciplinary approach. J Endocrinol Invest. 2021;44(12):2545–55. doi.org/10.1007/s40618-021-01649-7
10. Redondo A, Segura N. Consideraciones anestésicas en tumores neuroendocrinos: a propósito de un caso de paraganglioma. Rev. cuba anestesiol reanim. 2020,19(2):300-305. Disponible en: [http://scielo.sld.cu/scielo.php?script=sci\_arttext\&pid=S1726-67182020000100011\&lng=es\&nrm=iso](http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1726-67182020000100011&lng=es&nrm=iso).
11. Neumann HPH, Young WF J, Eng C. Pheochromocytoma and paraganglioma. N Engl J Med. 2019;381(6):552–65. doi.org/10.1056/NEJMra1806651
12. Fermandois M, Altamirano J, Rojas F, Román C, Pinto I. Perioperative management of paragangliomas and pheochromocytomas. Medwave. 2020;20(02):7830. doi.org/10.5867/medwave.2020.02.7830
13. Godoroja DD, Moldovan C, Tomulescu V. Actualities in the anaesthetic management of pheochromocytoma / paraganglioma. Acta Endocrinol (Buchar). 2021;17(4):557–64. doi.org/10.4183/aeb.2021.557
14. Naranjo J, Dodd S, Martin YN. Perioperative management of pheochromocytoma. J Cardiothorac Vasc Anesth. 2017;31(4):1427–39. doi.org/10.1053/j.jvca.2017.02.023
15. Buscemi S, Di Buono G, D’Andrea R, Ricci C, Alberici L, et al. Perioperative management of pheochromocytoma: From a dogmatic to a tailored approach. J Clin Med. 2021;10(16):3759. DOI: [https://doi.org/10.3390/jcm10163759](https://doi.org/10.3390/jcm10163759)
16. Bai S, Yao Z, Zhu X, Zidong L, Yunzhong J, et al. Comparison of transperitoneal laparoscopic versus open adrenalectomy for large pheochromocytoma: A retrospective propensity score-matched cohort study. Int J Surg. 2019;61:26–32. doi.org/10.1016/j.ijsu.2018.11.018
17. López JC. Manejo anestésico para el paciente Sometido a resección de Feocromocitoma. \[Tesis posgrado]. Universidad de Costa Rica. 2020-32. [https://hdl.handle.net/10669/81799](https://hdl.handle.net/10669/81799)
