Apartados
Resumen
Abstract
Introducción
Discusión
Conclusión
Referencias
Tomas Ruiz-Duran¹, Eder Jonathan Escamilla-Reynoso². ¹Médico residente de Anestesiología Cardiovascular del Instituto Nacional de Cardiología “Dr. Ignacio Chávez”, Ciudad de México. ²Medico adscrito Anestesiólogo Cardiovascular en Cardiopatías Congénitas del Instituto Nacional de Cardiología “Dr. Ignacio Chávez”. Ciudad de México.
Anestesia en México 2025;37(2): 165-170 https://doi.org/10.64221/aem-37-2-2025-014
Fecha de recepción 13 de diciembre 2024, fecha de revisión febrero 2025, fecha de publicación marzo 2025. dr.tomasruiz5@gmail.com
Palabras clave: Comunicación interauricular, Hipertensión pulmonar, milrinona, analgesia multimodal.
Abstract
Keywords: Atrial septal defect, Pulmonary hypertension, multimodal analgesia.
Introducción
Existen cinco tipos de defectos septales auriculares: foramen oval permeable, defecto del ostium secundum, defecto del ostium primum, defecto del seno venoso y defecto del seno coronario. Los defectos pequeños suelen cerrarse de manera espontánea, mientras que los defectos grandes, que no se cierran por sí solos, pueden requerir tratamiento percutáneo o quirúrgico para evitar complicaciones como accidentes cerebrovasculares, arritmias (1,2).
La mayoría de los niños con defectos interatriales aislados no presentan síntomas, pero las tasas de intolerancia al ejercicio, taquiarritmias auriculares, disfunción ventricular derecha e hipertensión pulmonar aumentan con el paso de la edad y la esperanza de vida se reduce en adultos con defectos no tratados. El riesgo de desarrollar enfermedad vascular pulmonar, una complicación potencialmente letal, es mayor en pacientes de sexo femenino y en adultos mayores con defectos no tratados. El cierre quirúrgico es seguro y eficaz y, cuando se realiza antes de los 25 años, se asocia con una esperanza de vida normal (2,3).
La comunicación interauricular congénita, puede llevar a un hiperflujo pulmonar debido al cortocircuito de sangre. Este cortocircuito aumenta la cantidad de sangre que pasa a través de la circulación pulmonar, lo que puede resultar en un incremento del flujo sanguíneo pulmonar y, eventualmente, en hipertensión pulmonar si no se corrige a tiempo. (4)
El incremento del flujo sanguíneo pulmonar puede causar remodelación vascular desfavorable, incluyendo disfunción endotelial pulmonar y aumento en el cizallamiento endotelial, lo que contribuye a la vasoconstricción y proliferación celular en el lecho vascular pulmonar. Este proceso puede desarrollar hipertensión arterial pulmonar, que es una complicación significativa en pacientes con defectos del septo auricular no tratados. Además, la literatura médica sugiere que la magnitud del cortocircuito de izquierda a derecha está influenciada por el tamaño de la comunicación interauricular, lo que afecta directamente el grado de hiperflujo (5).
El manejo anestésico de los defectos interatriales en pacientes que cursan con hipertensión pulmonar, requiere una estrategia que minimice la resistencia vascular pulmonar y a su vez no aumente la resistencia vascular sistémica, el uso de milrinona ha demostrado ser un vasodilatador pulmonar selectivo que puede mejorar la hemodinámica sin causar hipotensión sistémica significativa, lo cual es crucial en el contexto de la separación de la circulación extracorpórea sin tener grandes cambios hemodinámicos (6,7).
A la exploración física activo, reactivo, cráneo normo céfalo, pupilas isocóricas, mucosa oral hidratada, vía aérea IPID 6 puntos, cuello cilíndrico, tráquea central, sin plétora yugular, tórax simétrico expansible con adecuada mecánica ventilatoria, sin agregados, ruidos cardiacos rítmicos con presencia de soplo sistólico grado III/IV 2do espacio intercostal, resto sin alteraciones. Talla 1.36 m, peso 25 kg.
EKG: sinusal, con bloqueo completo de rama derecha.
Rx de tórax: arco aórtico a la izquierda, flujo pulmonar aumentado, hipertrofia de cavidades izquierdas y de ventrículo derecho, ICT 53 %.
Paraclínicos: Biometría hemática, química sanguínea y tiempos de coagulación dentro de rangos sin alteraciones para su edad.
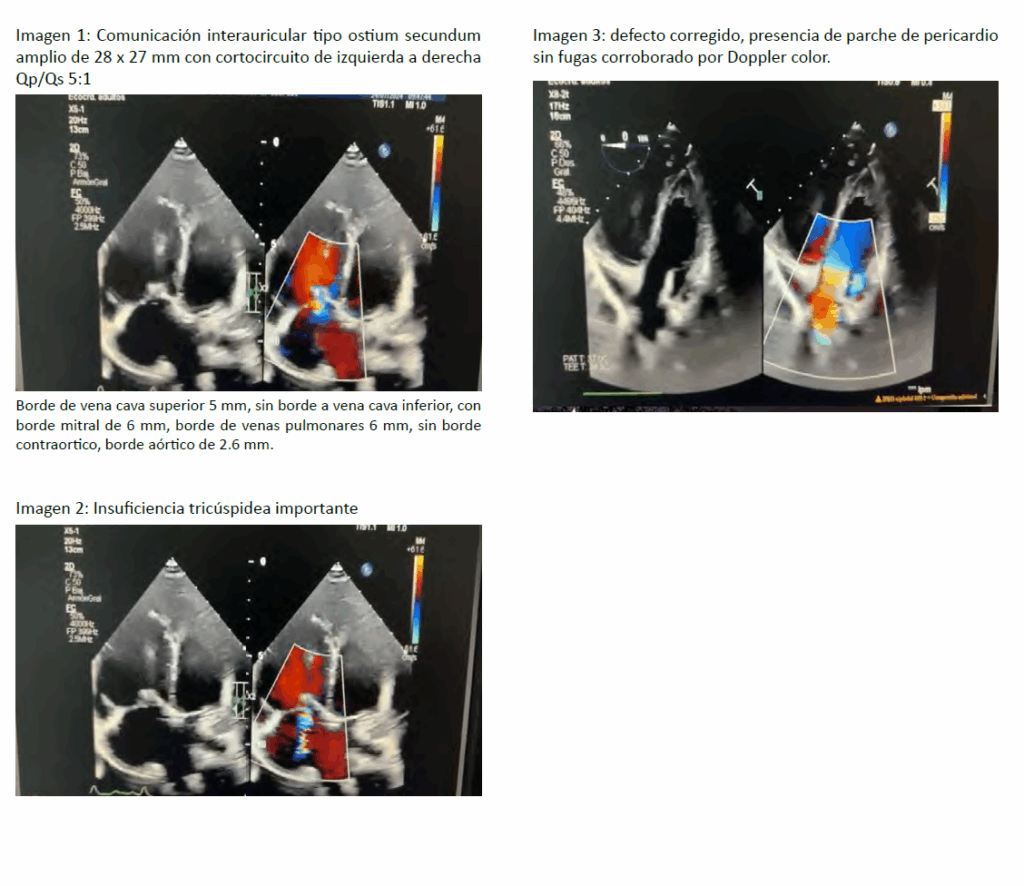
Ecocardiograma transtorácico: CIA ostium secundum amplia 28 x 27 mm, shunt izquierda a derecha que condiciona hiperflujo pulmonar con relación 5:1 Qp/Qs, dilatación importante de cavidades derechas, insuficiencia tricuspídea importante, insuficiencia pulmonar moderada, PMAP 28 mm Hg, función sistólica conservada, disfunción diastólica tipo 2 del ventrículo derecho, función sistólica y diastólica del VI conservada.
Escalas de valoración: Riesgo ASA III, NYHA ROSS II, RASCH -1:1, Aristóteles: 3.0
Se informó a familiares responsables respecto a la técnica anestésica y a los posibles riesgos y complicaciones del procedimiento anestésico, se resolvieron dudas y se firmó el consentimiento informado para procedimiento anestésico y de invasión.
Ingresa paciente a sala de operaciones, se realiza monitoreo hemodinámico no invasivo; FC 97 lat/min, SatO2 93 %, FR 18/min, T/A no invasiva 96/55 mm Hg, neuromonitoreo con BIS con un valor inicial de 93 y NIRS somático y cerebral con valores de 85 y 79 respectivamente.
Se realizó inducción anestésica inhalatoria con Sevofluorane a 8 volúmenes porcentuales, flujo de oxígeno a 5 L por minuto con FiO2 100 %. Una vez teniendo paciente en plano anestésico con BIS de 43 se canaliza acceso venoso periférico en antebrazo derecho con catéter 20G, se inicia inducción endovenosa midazolam 1.5 mg iv (para manejo de amnesia), fentanilo 75 μg iv, rocuronio 25 mg iv, lidocaína 25 mg iv, se otorga tiempo de latencia farmacológica y se realiza laringoscopia hoja MAC 2, Cormack 1, intubación al primer intento con cánula orotraqueal 5.5 tipo Murphy con neumotaponamiento 2 c.c., prueba de fuga negativa, intubación sin incidentes, se corrobora posición por clínica y capnografía, se fija cánula orotraqueal a 18 cm de comisura oral, se conecta a circuito semicerrado y se inicia ventilación mecánica: controlado por volumen, tidal 200 mL, FR 14/min, PEEP 5, I:E 2.
El monitoreo hemodinámico invasivo se realizó con transductores de presión para línea arterial y presión venosa central. Previo test de Allen en mano izquierda se procede a infiltrar lidocaína al 2 % 4 mg subcutáneo, se identifica pulso de arterial radial y se cánula arteria con técnica de Seldinger con catéter 22 G. Se conecta a transductor teniendo resultado de T/A invasiva de 109/66 mm Hg, posteriormente se posiciona paciente identificando triángulo de Sellidot y se realiza punción para identificar vena yugular derecha interna, una vez canulada se realiza colocación de catéter venoso central trilumen 5.5 Fr dicho a 13 cm, se corrobora adecuado retorno y se conecta a módulo de presión invasiva teniendo como registro PVC inicial de 8 mm Hg.
El manejo hipnótico durante el transanestésico fue con Sevofluorane manteniendo CAM entre 0.9 y 1.2 guiado por objetivos con BIS entre 40-50. Manejo de analgesia: perfusión continua de fentanilo entre 3.0 y 3.5 μg/kg/h.
Como tromboprofilaxis se manejó ácido tranexámico 2 mg/kg/h durante todo el procedimiento.
Adyuvantes: cloropiramina 5 mg iv, citicolina 750 mg iv como protector neurológico, paracetamol 370 mg iv como complemento de analgesia multimodal, ondansetron 4 mg iv, dexametasona 4 mg iv para el manejo preventivo de náuseas y vómito postoperatorio.
Iniciado el procedimiento quirúrgico, este fue tolerado de manera adecuada por el paciente, sin variabilidad significativa de la TAM no mayor a 90 mm Hg y menor a 65 mm Hg, asegurando adecuada perfusión tisular.
Los valores de NIRS cerebral durante procedimiento fueron máximo 85, mínimo 77, y para el somático máximo 79, mínimo 73. Se tomó muestra de tiempo de coagulación activado teniendo valor de 124 segundos.
Se administraron 7000 UI de heparina iv y una vez teniendo resultado de 430 seg de TCA se realizó canulación arterial y venosa sin complicaciones.
Se inicia derivación cardiopulmonar y se induce disminución de la temperatura hasta 34.0 °C, se procede al pinzamiento aórtico y se administraron 600 mL de solución cardioplégica del Nido hasta observar asistolia en el monitor.
El transcurso de la derivación cardiopulmonar y cierre del defecto con parche de pericardio fue sin eventualidades.
Se inicia el recalentamiento gradual hasta 35.5 °C y al despinzamiento aórtico se tiene ritmo de fibrilación ventricular por lo que se decide realizar desfibrilación con palas a 20 Joules, teniendo posterior salida a ritmo sinusal.
Teniendo 36.2 °C de temperatura se inicia separación de la circulación extracorpórea administrando volumen de manera gradual. Se inicia perfusión de norepinefrina a 0.04 μg/kg/min y milrinona 0.7 μg/kg/min manteniendo PAM > 65 mm Hg. El corazón presentaba adecuada contractilidad (macroscópica), se obtuvo equilibrio electrolítico y ácido-base durante la derivación cardiopulmonar, así como Hb >10, por lo cual se decide la interrupción del Bypass al 1er. intento sin eventualidades.
Se administran 143 mg de protamina sin eventualidades.
Durante cirugía se tiene la utilización de recuperador celular por lo que se realiza la administración de 214 ml recuperados.
Equipo de ecocardiografía realiza ecocardiograma transesofágico en el cual se identifica un adecuado cierre del defecto interatrial sin fugas residuales, así como adecuada contractilidad biventricular.
Se procede a realizar cierre de esternotomía, el cual transcurre sin mayor eventualidad y se da por concluido el procedimiento quirúrgico, teniendo un tiempo total de derivación cardiopulmonar de 52 minutos y tiempo de pinzamiento aórtico de 25 minutos.
Se detiene la perfusión continua de fentanilo que fue administrada por 115 minutos y posterior se realiza emersión de bloqueador neuromuscular por lisis farmacológica con sugammadex 50 μg iv.
Con ayuda de equipo de ecografía con sonda lineal se identifica sobre línea media axilar entre 4ta y 5ta costilla la fascia del músculo serrato anterior. Con ayuda de aguja ecogénica 50 mm se incide en plano identificando punta de aguja y se avanza hasta llegar a fascia del serrato. Previa aspiración con resultado hemático negativo, se administra ropivacaína 0.3 % 60 mg bilateral.
Posterior al bloqueo ecoguiado se procede a aspiración de secreciones. Paciente presenta ventilación espontánea y se decide realizar extubación dentro de sala de operaciones que transcurre sin eventualidades.
Se coloca mascarilla reservorio a 10 lt/min para evitar retención de CO2. Al momento de la extubación presenta reflejos protectores de vía aérea y deglución con un RAMSAY de 3 puntos, Aldrete 8/10 y ENA 0/10.
Se traslada paciente a unidad de cuidados intensivos pediátricos para continuar con su manejo.
Elmi-Sarabi y cols. mencionan que la administración de milrinona ha mostrado aumentar el gasto cardíaco y reducir la presión arterial pulmonar sistólica (SPAP), lo que facilita la separación de la derivación cardiopulmonar, sin aumentar la necesidad de inotrópicos intravenosos. Además, la combinación de milrinona inhalada con otros vasodilatadores pulmonares, como el epoprostenol inhalado, puede potenciar la respuesta vasodilatadora pulmonar, mejorando aún más la separación de la derivación cardiopulmonar y reduciendo el riesgo de complicaciones (9).
En estudios comparativos, por Imam y cols., la milrinona ha demostrado ser efectiva en mejorar parámetros hemodinámicos como la presión arterial pulmonar sistólica y el índice de saturación de oxígeno, siendo superior a otros tratamientos. Además, se ha observado que la milrinona puede reducir la duración de la estancia hospitalaria en comparación con vasodilatadores pulmonares como sildenafil (10).
En resumen, la milrinona es una opción terapéutica valiosa en el manejo de la hipertensión pulmonar en pacientes pediátricos con comunicación interauricular congénita.
La analgesia en el cuidado postoperatorio tras cirugía cardíaca es crucial para optimizar la recuperación del paciente, minimizar el estrés quirúrgico y reducir el uso de opioides. En el contexto de la cirugía cardíaca pediátrica, como se menciona en las guías de la American Association for Thoracic Surgery, se recomienda el uso de regímenes multimodales de analgesia que incluyan analgésicos no opioides como el acetaminofén intravenoso y el ketorolaco, para reducir la necesidad de opioides. Con la finalidad de disminuir el dolor y con ello mejorar la mecánica ventilatoria del paciente, reduciendo el riesgo de complicaciones pulmonares. Asimismo, al reducir el consumo de opioides se disminuye el riesgo de presentar estreñimiento, náuseas y vómito, así como retención urinaria y prurito (11).
El bloqueo del plano del serrato anterior es una técnica de anestesia regional que se utiliza como complemento en el manejo multimodal de anestesia para el control del dolor postoperatorio en cirugías torácicas. Esta técnica se utiliza debido a su simplicidad y eficacia en comparación con otros bloqueos más complejos como el bloqueo epidural torácico o el bloqueo paravertebral, que pueden ser técnicamente más complejos. En el contexto de la cirugía cardíaca pediátrica, este bloqueo se ha utilizado para el manejo del dolor post-toracotomía. Un estudio comparativo de Gado y cols. mostró que el bloqueo serrato anterior y el bloqueo de los nervios pectorales II (Pecs II) son igualmente eficaces para el manejo del dolor postoperatorio en comparación con el bloqueo del nervio intercostal. Además, el bloqueo del serrato anterior ha demostrado reducir significativamente el consumo de opioides postoperatorios y mejorar las evaluaciones de dolor en niños sometidos (12).
Referencias:
1. Torres AJ. Evaluación hemodinámica de los defectos del tabique auricular. J Thorac Dis. 2018;10(Suppl 24)\:S288. DOI: 10.21037/jtd.2018.02.17
2. Geva T, Martins JD, Wald RM. Defectos del tabique auricular. Lancet (Londres, Inglaterra). 2014;383(9932):1921-32. doi:10.1016/S01
3. Naqvi N, McCarthy KP, Ho SY. Anatomía del tabique auricular y comunicaciones interauriculares. J Thorac Dis. 2018;10(Supl 24)\:S2837. doi:10.21037/jtd.2018.02.18.
4. Adatia I, Kothari SS, Feinstein JA. Hipertensión pulmonar asociada a cardiopatía congénita: enfermedad vascular pulmonar: perspectiva global. Pecho. 2010;137(6 supl):52S-61S. DOI 10.1378/chest.09-2861.
5. Rychik J, Gullquist SD, Jacobs ML, Norwood WI. Análisis ecocardiográfico Doppler del flujo en el conducto arterioso de lactantes con síndrome del corazón izquierdo hipoplásico: relación de los patrones de flujo con la oxigenación sistémica y el tamaño de la comunicación interauricular. J Am Soc Ecocardiogr. 1996;9(2):166-73. doi:10.1016/s0
6. Elmi-Sarabi M, Jarry S, Couture EJ, et al. Pulmonary vasodilator response of combined inhaled epoprostenol and inhaled milrinone in cardiac surgical patients. Anesth Analg. 2023 Feb 1;136(2):282-94. doi: 10.1213/ANE.0000000000006192. Epub 2022: PMID: 36121254.
7. Dean B. Andropoulus, Emad B. Mossad, Erin A. Gottlieb. Anesthesia for Congenital Heart Disease. Hoboken, NJ, Estados Unidos de América: Wiley-Blackwell; 2023. 624–633 p.
8. Menillo AM, Lee LS, Pearson-Shaver AL. Atrial Septal Defect. En: StatPearls. Treasure Island (FL): Publicación de StatPearls; 2022: [https://www.ncbi.nlm.nih.gov/books/NBK535440/](https://www.ncbi.nlm.nih.gov/books/NBK535440/)
9. Elmi-Sarabi M, Jarry S, Couture EJ, et al. Respuesta vasodilatadora pulmonar del tratamiento combinado con epoprostenol y milrinona inhalados en pacientes sometidos a cirugía cardíaca. Anesth Analg. 2023;136(2):282-94. doi:10.1213/ANE.0000000000006192.
10. Imam SS, El-Farrash RA, Taha AS, Saleh GA. Milrinona versus sildenafil en el tratamiento de la hipertensión pulmonar persistente neonatal: un ensayo controlado aleatorizado. Cardiovasc Pharmacol J. 2022;80(5):746-752. doi:10.1097/FJC.0000000000001332.
11. Fuller S, Kumar SR, Roy N, et al. The American Association for Thoracic Surgery Congenital Cardiac Surgery Working Group 2021 consensus document on a comprehensive perioperative approach to enhanced recovery after pediatric cardiac surgery. J Thorac Cardiovasc Surg. 2021 Sep;162(3):931-954. doi: 10.1016/j.jtcvs.2021.04.072. Epub 2021 May 1. PMID: 34059337.
12. Bloqueo del plano anterior del serrato en pacientes pediátricos sometidos a cirugías torácicas: un ensayo controlado aleatorizado. Gado AA, Abdalwahab A, Ali H, Alsadek WM, Ismail AA. Revista de anestesia cardiotorácica y vascular. 2022;36(8PtA):2271-2277. doi:10.1053/j.jvca.2021.09.014