Apartados
Resumen
Abstract
Introducción
Discusión
Referencias
Atresia Esofágica con Fístula Traqueoesofágica Reporte de Caso
Esophageal Atresia with Tracheoesophageal Fistula Case Report
1Cesar Daniel Hernandez-Pérez. 2Carlos Vega-Francisco. 1Médico Anestesiólogo del Hospital ISSSTE, Querétaro, Qro. México. 2Médico Anestesiólogo Pediatra IMSS Hospital Regional 1, Querétaro, Qro. México.
Anestesia en México 2025; 37(3): 247–251 https://doi.org/10.64221/aem-37-3-2025-026
Fecha de recepción febrero 2025, fecha de revisión mayo 2025, fecha de publicación septiembre 2025.
danielhdz1291@gmail.com
Resumen
La Atresia Esofágica (AE) es una patología congénita en donde una porción del esófago termina en un fondo de saco ciego la cual tiende a presentarse en conjunto con una Fístula Traqueoesofágica (FTE), que corresponde a una comunicación anómala entre la tráquea y el esófago. Ambas condiciones son las anomalías congénitas más frecuentes a nivel de esófago y tráquea. El objetivo de este trabajo es describir los resultados de la actuación anestesiológica en un paciente con AE y FTE. Se presenta un caso clínico de un neonato de 10 días de vida con diagnóstico de AE, quien inicia su padecimiento actual horas después de su nacimiento con congestión nasal asociado a reflujo gastroesofágico, posteriormente con datos de dificultad respiratoria, polipnea, tiraje intercostal, retracción xifoidea, cianosis, llanto y distermias con rechazo a la vía oral, sin micciones y disminución de evacuaciones; con presencia de somnolencia, succión débil y rechazo a las tomas con jeringa. Llanto inconsolable por lo que acude a urgencias en donde se intentó colocar sonda orogástrica a derivación sin embargo tras no haber permeabilidad de la misma se realiza radiografía con contraste hidrosoluble para descartar atresia esofágica; posteriormente se ingresa a quirófano para manejo quirúrgico por cirugía pediátrica para plastia esofágica con cierre quirúrgico. Palabras clave: Atresia Esofágica, fistula traqueoesofágica, cirugía torácica, anestesia
Abstract
Esophageal atresia (EA) is a congenital anomaly in which a portion of the esophagus ends in a blind pouch. It usually occurs in conjunction with a tracheoesophageal fistula (TEF), which corresponds to an anomalous communication between the trachea and the esophagus. Both conditions are the most frequent congenital anomalies at the level of the esophagus and trachea. The objective of this work is to describe the results of anesthesiological intervention in a patient with esophageal atresia and tracheoesophageal fistula, as well as the anesthetic considerations for the surgical treatment of this pathology. A clinical case is presented of a 10-day-old neonate diagnosed with esophageal atresia who began his Anestesia en México 2025; Volumen 37 (3) : 247-251 septiembre-diciembre 248 current condition hours after birth with nasal congestion associated with gastroesophageal reflux, later with data of respiratory distress, polypnea, intercostal retraction, xiphoid retraction, cyanosis, crying and dysthermia with rejection to the oral route, without urination and decreased bowel movements; with the presence of drowsiness, weak suction and rejection to syringe feedings, inconsolable crying for which he went to the emergency room where an orogastric tube was attempted to be placed by diversion; however, after there was no permeability of the same, an x-ray with water-soluble contrastwasperformedtoruleoutesophageal atresia; later he was admitted to the operating room for surgical management by pediatric surgery for esophageal plasty with surgical closure. Keywords: Esophageal atresia, tracheoesophageal fistula, thoracic surgery, anesthesia
Introducción
La Organización Mundial de la Salud (OMS, 2020) manifiesta que las anomalías congénitas son defectos de nacimiento, trastornos o malformaciones al nacer las cuales son consideradas como estructurales o funcionales y ocurren durante la vida intrauterina; se identifican durante el embarazo, al nacer o después del parto. Cada año 303.000 recién nacidosfallecen durante las primeras cuatro semanas devida anivelmundialdebidoamalformacionesoanomalías congénitas. Por lo cuales son consideradas como unas de las principales causas de muerte en la niñez, enfermedades crónicas y discapacidad en muchos países(1).
La AE es una patología congénita en donde una porción del esófago termina en un fondo de saco ciego la cual tiende a presentarse en conjunto con una FTE, que corresponde a una comunicación anómala entre la tráquea y el esófago. Ambas condiciones son las anomalías congénitas más frecuentes a nivel de esófago y tráquea (2).
La AE asociada a FTE es una malformación infrecuente (1:2.500-4.500 recién nacidos vivos), incompatible con la vida por lo que se considera una urgencia quirúrgica del periodo neonatal. El 85 % de los casos corresponden a la variante IIIb/C de la clasificación de Gross y Vogt. El 30 % de los pacientes son prematuros o presentan bajo peso al nacimiento (< 1.500 g) y el 50 % presentan otras anomalías asociadas, principalmente cardíacas. En algunos casos pueden formar parte de síndromes como VACTERL y CHARGE. En la presentación de casos sin comorbilidad agregada, la supervivencia puede alcanzar el 97 %. En casos con cardiopatías congénitas mayores o con bajo peso al nacimiento son considerados predictoresindependientes de mortalidad y de eventos críticos postoperatorios(3)
El diagnóstico de la AE es confirmado porla imposibilidad de hacer progresar una sonda nasogástrica hasta el estómago, así como presencia de abundantes secreciones orales, tos o episodios de cianosis después de la ingesta alimentaria. La toma de una radiografía de tórax contrastado con una sonda nasogástrica u orogástrica que se pase a la bolsa esofágica superior puede proporcionar el diagnóstico (4). El propósito del caso clínico que a continuación se expone, es poner de manifiesto el plan anestésico exitoso que se desarrolló en un hospital universitario de segundo nivel de atención,enunreciénnacidoatérminoconAEyFTE,teniendo en consideración lasrecomendaciones perioperatorias.
Presentación del caso
Neonato de diez días de vida con diagnóstico de AE, quien se recibe para plastia esofágica con cierre quirúrgico. Producto de la primera gestación a término de 38.5 semanas de gestación (sdg) por Capurro con peso y talla adecuadoparalaedadgestacional.Madreconantecedente de infección de vías urinarias y cervicovaginitis primer y segundo trimestre; parto por cesárea por desproporción cefalopélvica y falta de progresión de trabajo de parto. Peso al nacer de 3430 gramos, adaptación espontanea, en su estancia con datos de reflujo gastroesofágico por lo que indican metoclopramida y dan alta conjunta.
Antecedentes heredofamiliares: Sin importancia. Padecimiento actual: inicia horas después de su nacimiento con congestión nasal asociado a reflujo gastroesofágico, se realizan aseos nasales y dan de alta. Cuatro días posteriores al nacimiento inicia con datos de dificultad respiratoria, polipnea, tiraje intercostal, retracción xifoidea, cianosis, llanto y distermias con rechazo a la vía oral, sin micciones y disminución de evacuaciones; posteriormente inicia con presencia de somnolencia, succión débil y rechazo a las tomas con jeringa, llanto inconsolable por lo que acude a urgencias en donde indican ingreso a UCIN por persistencia de dificultad respiratoria. En UCIN persiste con datos de dificultad respiratoria por lo que se decide manejo avanzado de la vía aérea con intubación orotraqueal. En ese momento se intentó colocar sonda orogástrica a derivación sin embargo tras no haber permeabilidad de la misma se realiza radiografía con contraste hidrosoluble para descartar atresia esofágica. No se realiza broncoscopia diagnostica ya que https://doi.org/10.64221/aem-37-3-2025-026 Anestesia en México 2025; Volumen 37 (3) : 247-251 septiembre-diciembre 249 en la unidad no se cuenta con el recurso. PLAN: Se decide manejo quirúrgico plastia esofágica con cierre quirúrgico.
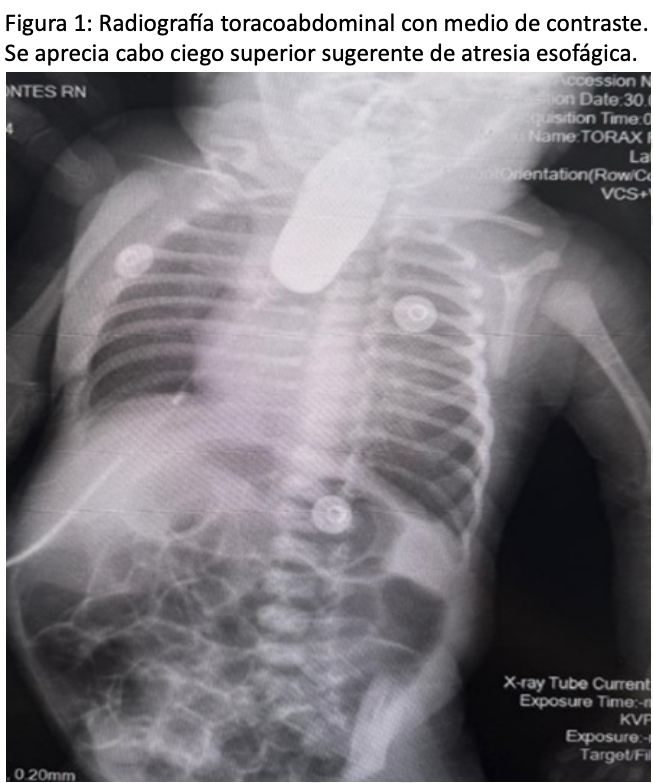
Al momento de la valoración anestésica, se encontró a paciente en cuna, bajo calor radiante, palidez mucocutánea, no lesiones cutáneas evidentes, bajo sedación (RASS -4), reactiva a estímulos externos, no deformidades craneofaciales evidentes, fontanelas normotensas, pupilas 2 mm isocóricas normo reactivas a la luz, narinas con sonda bilateral de aspiración e irrigación, cuello cilíndrico, sin masas o vía aérea orointubada con cánula 3.5 fija a 9 cm en comisuralabial, ventilaciónmecánicacontroladoporpresión, Presiones Inspiratorias Pico (PIP): 8, Relación Inspiraciónes: Espiración (RI;E) 1:4.3; Inspiración: 0.4 segundos. Espiración:1.74 segundos, volumen minuto: 0.81, presión espiratoria final positiva (PEEP) 5, Fracción Inspirada de O2 (FIO2) 30 %, tórax ventilación pulmonar simétrica, crépitos finos bilateral, precordio calmo,ruidos cardiacosrítmicos, no se auscultan soplos, abdomen globoso, peristalsis presente adecuada frecuencia, no signos de irritación peritoneal, genitales diferido, extremidades cuenta con catéter PICC miembro superior izquierdo 2 lúmenes, eutróficas móviles, no edemas, llenado capilar dossegundos. Medicamentos al momento: sedación a base de Dexmedetomidina 0.3 µg/kg/hora apoyo con Dopamina 5 µg/kg/min, diurético furosemida 0.3 mg/kg/día por razón necesaria, mezcla base 15 mL/hora, antimicrobiano: vancomicina más cefotaxima día dos. Los exámenes preoperatoriosse muestran en la (Tabla 1).

Se le otorga RAQ: E3B.ASA III. Plan Anestésico: Anestesia General Balanceada con Monitoreo cardiaco tipo 1. Ingresa paciente masculino de 10 días de vida a quirófano procedente de UCIN previo consentimiento informado y firmado por los padres para cirugía plastia esofágica con cierre quirúrgico. Ingresa orointubada con cánula 3.5 sin globo con apoyo ventilatorio Ambu y O2 a 5 lt x minuto, con dexmedetomidina a 0.3 µg/kg/h. Dopamina 10 µg/ kg/h, y solución base. Se suspende dexmedetomidina y se mantiene dopamina a 10 µg/kg/minuto; se realiza inducción para cambio de tubo con el objetivo de asegurar vía aérea, dosis de inducción fentanilo 20 µg i.v, lidocaína 3 mg i.v, cisatracurio 2 mg y Propofol 6 mg. se realiza laringoscopia directa con hoja Miller 0. Se retiró tubo y se coloca Murphy 3.5 con globo al primer https://doi.org/10.64221/aem-37-3-2025-026 Anestesia en México 2025; Volumen 37 (3) : 247-251 septiembre-diciembre 250 intento sin complicaciones. Se corroboró por capnografía, neumotamponamiento 2 cc. Se pasa a ventilación mecánica por volumen, Volumen Tidal 25 mL, frecuencia respiratoria (FR) 30 rpm, I:E 1:2.5, PEEP 5, FiO2 del 35- 50 %; se coloca paciente decúbito lateral derecho bajo sabana térmica y se inicia procedimiento quirúrgico.
Mantenimiento Halogenado Sevoflurane CAM > 0.8, Fentanilo perfusión a 0. 04 µg/kg/minuto, dosis total 30 µg i.v. Concentración plasmática 3.2 ng, cisatracurio fraccionado dosis total 6 mg, paciente transanestésico presenta hipotensión sostenida por lo que se inicia norepinefrina a 0.02-0.10 µg/kg/minuto para mantener Tensión arterial media (TAM) perfusoras 45-60 mm Hg.
Hemodinamia: con medias de tensión arterial (TA) 70/50 mm Hg, con TAM 60 con apoyo de vasopresor, frecuencia cardiaca (FC) 133 lpm, frecuencia respiratoria (FR) 30 rpm, Saturación periférica de oxígeno (SatO2) 97 %, Temperatura 36° C, EtCO2 35. Adyuvantes: cefotaxima 145 mg, dexametasona 0.4 mg, paracetamol30mgi.v.Balancehídrico:ingresos107mL,egresos 110mL,balancetotal-3mL,sangrado10mL.Tiempoquirúrgico 3 horas, tiempo anestésico 3 horas con 40minutos.
Termina procedimiento quirúrgico sin incidentes, pacientes sin criterios de extubación por lo que se envía a Unidad de cuidados intensivos neonatales orointubada, con apoyo de norepinefrina a 0.10 µg/kg/minuto. Dopamina a 5 µg/ kg/minuto con signos vitales TA 64/42 mm Hg, FC 132 lpm, Fr 30rpm, SatO2 99 %, RASS -5. Se mantiene analgesia posquirúrgica con Fentanilo en infusión a 2 µg/kg.
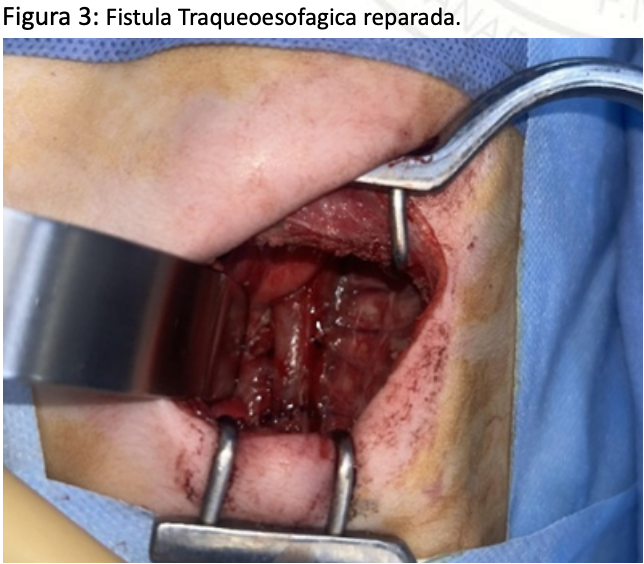
Paciente se mantiene en UCIN por 15 días posteriores al procedimiento quirúrgico bajo sedoanalgesia con midazolamy fentanilo por cinco días hasta retiro de cánula orotraqueal. posteriormente se realizó esofagograma al séptimo día posquirúrgico sin evidencia de fistula por lo que se retira sonda nasogástrica y se inicia alimentación por succión con buena tolerancia sin regurgitaciones ni vómitos. Previo a su egreso valoracion por neurología y cardiología como parte de protocolo sin hallazgos patológicos, por lo que se decide su egreso y seguimiento por consulta externa por parte de pediatría.
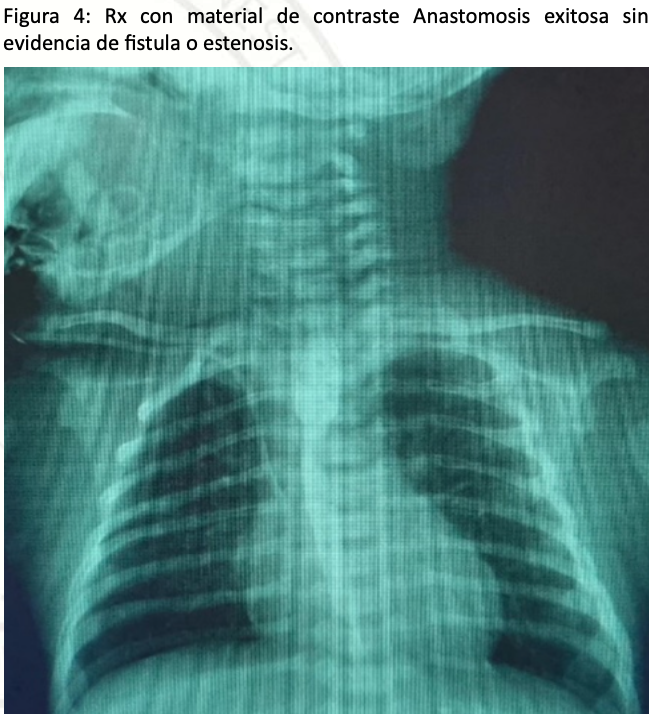
Discusión
La AE se asocia una elevada morbimortalidad a corto plazo si no es corregida quirúrgicamente, por lo que debe ser considerada una urgencia quirúrgica. Por su alta complejidad, el tratamiento perioperatorio debe realizarse por equipos multidisciplinares con experiencia en neonatología (3). La supervivencia de los recién nacidos con esta patología es cerca del 95-97 %, los factores responsables de optimizar estos valores son, la ventilación perioperatoria y el manejo clínico intensivo principalmente, así como la optimización del abordaje anestésico-quirúrgico.
El tratamiento quirúrgico cuenta con importantes consideraciones anestésicas y supone un desafío para los médicos anestesiólogos; principalmente la ventilación pulmonar (4). El abordaje y manejo de la vía aérea de los pacientes con AE asociada a FTE constituye uno de los grandes retos en anestesia e impacta directamente en los desenlaces perioperatorios. Un paso crítico es el posicionamiento del tubo endotraqueal, que debe estar distal a la fístula, pero por encima de la carina (4).
En el caso presentado no se pudo realizar intubación bronquial selectiva dadas las condiciones del paciente, además de no contar con fibroscopio pediátrico sin embrago se realizó intubación mediante un tubo endotraqueal calibre 3,5 con neumotaponamiento para asegurar vía aérea, se comprobó ventilación en ambos campos por auscultación y capnografía.
En el trabajo de Blázquez (3) menciona que la extubación temprana a las 24 horas de la intervención es posible, disminuye el tiempo de exposición de la sutura quirúrgica al tubo endotraqueal. No obstante, la decisión del momento de extubación debe ser individualizada, se debe tener en cuenta las características del paciente, duración de la cirugía, tensión de la anastomosis, dificultad de ventilación intraoperatoria y la calidad del control de dolor posoperatorio. En este caso, el paciente se envió a la unidad de cuidado intensivos neonatales intubado ya que no cumplía criterios de extubación, sin embargo, se extubo cinco días posteriores sin complicaciones y buen pronóstico.
En cuanto a las estrategias analgésicas el manejo deberá ir encaminado a una estrategia multimodal: AINES, opioides, ketamina, bloqueos regionales y analgesia peridural (5).
Conclusiones
La AE es una malformación infrecuente que cuando se presenta debe ser manejado con tratamiento multidisciplinario; es una urgencia quirúrgica que debe de corregirse lo antes posible ya que de eso dependerá su pronóstico y complicaciones futuras. La seguridad de la vía aérea y una ventilación efectiva en el manejo anestésico son las claves en el manejo de esta enfermedad. Los anestesiólogos deben tener en consideración la situación clínica del paciente, la existencia de comorbilidad, así como el tipo de abordaje quirúrgico. Debería ser evaluado el papel de los dispositivos broncoscopios y de ser posible tenerlo disponible, así como distintas alternativas expuestas para obtener una ventilación efectiva y exclusión de la fístula. Así bien es importante analizar la efectividad de las diferentes pautas de analgesia, comparando las diferencias entre las modalidades sistémicas y regionales y la incidencia de complicaciones.
Bibliografía
-
Cando Naranjo CJ, Jiménez Mejía GN, Benítez Crespo MJ, Galarza Páliz FG.
Atresia esofágica, diagnóstico, tratamiento y cuidados post quirúrgicos.
RECIAMUC, 2022;6(3), 111-118.
https://doi.org/10.26820/reciamuc/6.(3).julio.2022.111-118 -
Marín Zúñiga J, Carvajal Barboza F, Montes de Oca MS.
Actualización sobre el manejo de la atresia esofágica neonatal.
Rev. méd. sinerg. 1 de agosto de 2023. [citado 4 de noviembre de 2024];8(8):e1090.
Disponible en:
https://revistamedicasinergia.com/index.php/rms/article/view/1090 -
Blázquez E, Laguillo MA, Ariza TS, Avilés López-Millán JM.
Tratamiento anestésico del neonato con atresia de esófago asociada a fístula traqueoesofágica y ano imperforado.
Rev. Esp. Anestesiol. Reanim. 2013;60(10):589-593; disponible en.
http://dx.doi.org/10.1016/j.redar.2012.10.001 - Díaz de la Rosa C, Vega Cardulis Emilio, Rojas Santana Omar. Consideraciones anestésicas en recién nacido con atresia y fístula traqueoesofágica. Revista Cubana de Anestesiología y Reanimación, 2023;22. http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S172667182023000100011&lng=es&tlng=es
-
Rivera D, Parra J, Rodríguez J.
Manejo anestésico en corrección de atresia esofágica en recién nacido.
Revista Chilena de Anestesiología 2020; 49: 277-280.
Disponible:
https://doi.org/10.25237/revchilanestv49n02.13
