Apartados
Resumen
Abstract
Introducción
Caso clínico
Discusión
Conclusión
Referencias
1Lujano-Téllez Mariana Chantal. 2Peyro-Arenas Laura Helena. 1Médico Especialista de Anestesiología en el Hospital General de Tlaxcala Lic Anselmo Cervantes Hernández. Tlaxcala, México. 2Anestesiólogo pediatra adscrito al Hospital General Durango. Profesor adjunto del Diplomado Manejo Anestésico Integral del paciente Pediátrico. México.
Anestesia en México 2026;38(1): 93-97. https://doi.org/10.64221/aem-38-1-2026-014
Fecha de recepción octubre 2025, fecha de revisión noviembre 2025, fecha de publicación enero 2026.
mariana-ch1@hotmail.com
El manejo del dolor perioperatorio en cirugía ortopédica pediátrica representa un reto clínico importante, debido a las consideraciones anatómicas, fisiológicas y psicológicas propias del paciente pediátrico. El bloqueo de plexo braquial supraclavicular (BPBS), guiado por ultrasonido ha emergido como una técnica eficaz y segura para proporcionar anestesia regional en procedimientos de extremidad superior. Esta técnica permite una visualización directa de las estructuras anatómicas, reduce el riesgo de complicaciones y mejora la efectividad del bloqueo comparado con métodos tradicionales, basados en referencias anatómicas o neuroestimulación sola (1,2). Niño de 10 años que, tras una fractura de radio distal y complicaciones graves con anestesia general (laringoespasmo severo), fue sometido en segundo tiempo a cirugía correctiva, utilizando anestesia regional, mediante bloqueo supraclavicular del plexo braquial guiado por ultrasonido. Esta técnica permitió evitar una nueva anestesia general, ofreciendo un bloqueo eficaz sin eventos adversos. Discusión: Para evitar las complicaciones propias de la anestesia general se cambió a una anestesia regional guiado por ultrasonido. Conclusión: El caso ilustra la viabilidad de la anestesia regional como alternativa segura en población pediátrica. La guía ecográfica optimiza la técnica y reduce los riesgos. Esta estrategia debe considerarse en contextos donde la anestesia general representa un riesgo significativo.
Palabras clave: anestesia regional, pediatría, laringoespasmo, ultrasonido, plexo braquial.
Abstract
Perioperative pain management in pediatric orthopedic surgery represents a significant clinical challenge due to the unique anatomical, physiological, and psychological considerations of pediatric patients. Ultrasound-guided supraclavicular brachial plexus block (SCB) has emerged as an effective and safe technique for providing regional anesthesia in upper limb procedures. This approach allows direct visualization of anatomical structures, reduces the risk of complications, and enhances block efficacy compared to traditional methods based on anatomical landmarks or neurostimulation alone (1,2). We present the case of a 10-year-old boy who, following a distal radius fracture and severe complications with general anesthesia (severe laryngospasm), underwent corrective surgery at a later date using regional anesthesia via ultrasound-guided supraclavicular brachial plexus block. This technique successfully avoided the need for repeat general anesthesia and provided effective surgical anesthesia without adverse events. Discussion: To prevent complications associated with general anesthesia, the anesthetic plan was switched to ultrasound-guided regional anesthesia. Conclusion: This case illustrates the feasibility of regional anesthesia as a safe alternative in pediatric patients. Ultrasound guidance optimizes the technique and minimizes risks. This strategy should be considered in clinical scenarios where general anesthesia poses significant risks.
Keywords: regional anesthesia, pediatrics, laryngospasm, ultrasound, brachial plexus.
Introducción
La anestesia general en niños con antecedentes de complicaciones respiratorias graves representa un reto clínico significativo. El laringoespasmo es una de las complicaciones más temidas, debido al potencial compromiso de la vía aérea (VA) y su evolución hacia hipoxia o incluso paro cardiorrespiratorio (3). En este contexto, la anestesia regional guiada por ultrasonido se ha consolidado como una opción terapéutica segura y eficaz, particularmente en intervenciones ortopédicas de extremidades (4,5).
Se trata de paciente masculino de 10 años, después de haber sufrido una caída durante un partido de futbol escolar. Posteriormente, el niño refirió dolor intenso en la región de la muñeca derecha, acompañado de inflamación y dificultad a la movilización. Se observó deformidad visible en la articulación de la muñeca y aumento de volumen con equimosis leve.
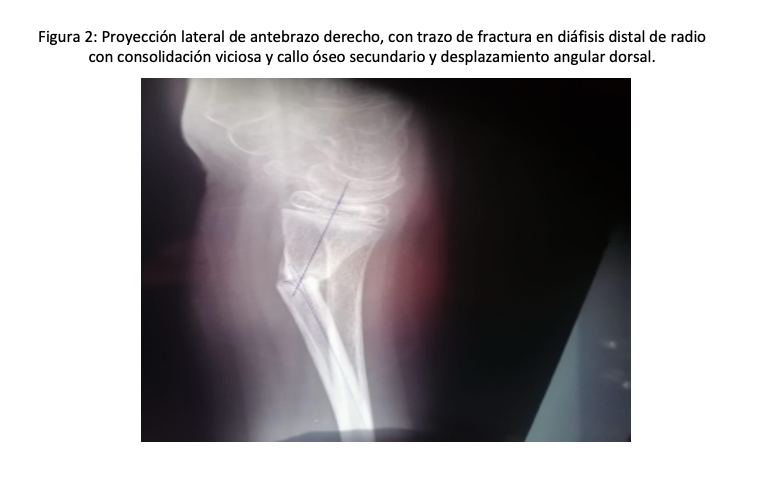
A la exploración física aumento de volumen y deformidad visible en la región distal del antebrazo derecho; a la palpación se evidencia dolor localizado en el radio distal con presencia de crepitación ósea. La movilidad está considerablemente limitada tanto de forma activa como pasiva en la articulación de la muñeca. La evaluación neurológica no muestra alteraciones sensitivas ni motoras, y en la evaluación vascular se encuentran pulsos periféricos presentes con llenado capilar adecuado. Se diagnosticó con rayos X fractura de diáfisis distal de radio derecho, mínimamente desplazada, candidato a manejo con reducción cerrada con fijación interna con clavillo Kirschner; se realizó procedimiento, bajo anestesia regional con bloqueo de plexo braquial supraclavicular por anatomía, con analgesia insuficiente, con cambio de técnica a anestesia general balanceada. Presentó complicaciones en la fase de emersión: dificultad respiratoria progresiva caracterizada por estridor inspiratorio, tiraje intercostal y ausencia de entrada de aire bilateral compatible con laringoespasmo severo. Se acompañó de hipercapnia sostenida, evidenciada por un aumento significativo en los niveles de CO2 al final de la espiración (EtCO2 > 60 mm Hg) y signos clínicos de retención de dióxido de carbono (taquicardia, diaforesis y somnolencia). Después de la resolución del evento con ventilación por mascarilla facial hasta normalizar parámetros respiratorios y niveles de CO2, posterior a extubación fue trasladado a recuperación bajo monitoreo.
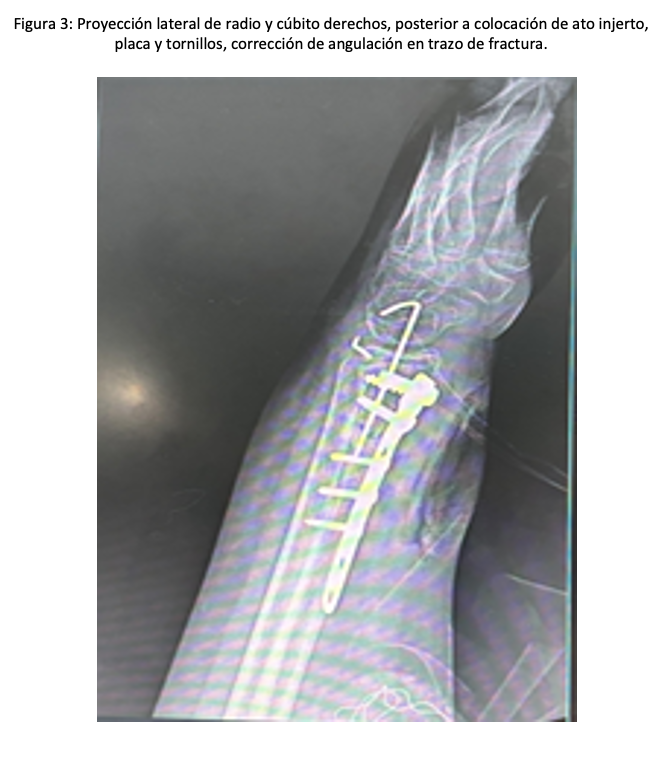
En la consulta externa con radiografía de control, se evidenció fracaso del tratamiento ortopédico con consolidación viciosa y osteoclasia del hueso afectado. Por lo que fue candidato a resolución quirúrgica; por lo que se proyectó tiempo quirúrgico para el 21 de mayo del 2025, donde se sometió a reducción abierta, fijación interna con placa convencional para radio distal derecho y clavillo Kirschner 1.2 mm más osteclasia y colocación de injerto autólogo. Preoperatorios normales.
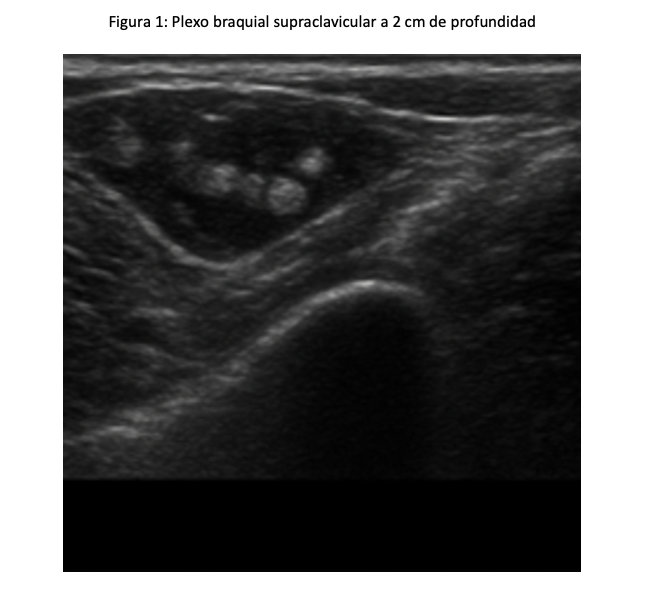
Se planificó un BPBS derecho ecoguiado con ultrasonido con transductor lineal 3.5 MHZ, con ganancias al 60 %; se realizó el cálculo de volumen de Ropivacaina a 0.2 mL por kilogramo de peso, el niño pesó 65 kg, así que se le administró 13 mL y fue a una concentración de 0.5 % con un total de 65 mg, se tomó 8.6 mL de Ropivacaina al 0.75 % y 4.4 mL de agua inyectable para hacer esa concentración. Se realizó firma de consentimiento informado por los padres tras explicar el procedimiento detalladamente y se explicó al paciente en términos adecuados a su edad, debido a la buena cooperación del niño, se decidió no realizar sedación previa al bloqueo. Se colocó al niño en decúbito supino con la cabeza girada al lado izquierdo, su brazo derecho fue adosado a su cuerpo. Se realizó asepsia y antisepsia de región anterior de cuello derecho, se colocaron tres campos en forma triangular a nivel del cuello y se colocó gel conductor del US, se posicionó el transductor en orientación transversal sobre la fosa supraclavicular, justo por encima de la clavícula, lateral al músculo esternocleidomastoideo; se identificaron las estructuras anatómicas de seguridad, la arteria subclavia (hipoecoica y pulsátil ), la primera costilla ( hiperecoica, curva y profunda), el plexo braquial de aspecto de racimo de uvas a dos cm de profundidad, lateral a la arteria subclavia. Se insertó la aguja stimuplex ultra 360 de 22G de 0.7 x 50 mm en técnica en plano, bajo visión ecográfica hacia el plexo braquial, cuidando evitar vasos y pleura, se aspira antes de inyectar el anestésico local, para evitar inyección intravascular y se observó hidrodisección, desplazando las estructuras y rodeando los troncos nerviosos. Se administraron lentamente los 13 mL de Ropivacaina al 0.5 %. (Figura 1). La latencia fue de ocho minutos con bloqueo motor y sensitivo adecuado; se colocaron puntas nasales a 2L y se administró sedación endovenosa para complementar con midazolam 3 mg en total y 150 µg de fentanilo, manteniendo ventilación espontánea, Ramsay 2, procedimiento quirúrgico con duración de 120 minutos, no se presentó ninguna complicación. Dexametasona (6.5 mg), ketorolaco (30 mg) para analgesia posoperatoria y ondansetron (4 mg). El niño fue trasladado a la unidad de cuidados postanestesicos (UCPA) para observación, se recuperó de la sedación sin incidentes y se egresó a su domicilio. (Figura 2 y 3).
En la literatura el FR lo describen como una patología que está muy localizada perturbando la entrada arterial específicamente de la piel de los dedos de las manos y los pies, la punta de la nariz y las orejas, los cuales tienen características estructurales y funcionales especializadas para la termorregulación (5,6) esto es explicado por mecanismos de vasoconstricción dados por el aumento de la endotelina 1, disminución de la actividad del óxido nítrico, así como al aumento de actividad de receptores adrenérgicos (1), varios cambios moleculares sumados al papel del sistema nervioso aferente en el receptor iónico TRPM8, que se comunica con el hipotálamo por diferentes sustancias, principalmente por la norepinefrina, generan cambios vasculares (2) y a su vez cambios en el tono vascular. Una de las explicaciones para este fenómeno es el aumento de GMPc que a su vez disminuye el calcio intracelular en el musculo liso provocando un desequilibrio entre la vasodilatación y la vasoconstricción (3). Clínicamente se puede caracterizar en primario y secundario, dado por su mecanismo molecular diferenciándolos, en el que hay un aumento de la actividad de los receptores alfa adrenérgicos, en contraste a un daño endotelial temprano que termina en obstrucción del flujo, respectivamente (4) . Así mismo, se describen métodos paraclínicos para diagnosticarla, como causas secundarias, tal y como, la que presentó nuestra paciente. Se describen tratamientos con vasodilatadores, análogos de prostaglandinas (7), manejo antiplaquetario e incluso simpatectomía química o quirúrgica, que no cuenta con evidencia concluyente de su utilidad (8). En que muchas ocasiones las medidas generales son bastantes y no es preciso utilizar tratamiento farmacológico.
Se describe que el 90 % de la pérdida es a través de la piel (9) y para prevenir ello, se utilizan mecanismos de calentamiento cutáneo que los podemos clasificar en activos y pasivos. Referente a los activos, en una revisión sistemática realizada por Brito Poveda (9), encontró al comparar diferentes sistemas, mayor efectividad del sistema de circulación de agua calentada comparado al sistema de aire forzado calentado (10), aunque este último se ha considerado el método más eficaz preoperatorio para prevenir complicaciones secundarios a la hipotermia (11); y es el método activo que junto a la infusión de líquidos calientes utilizamos en nuestros quirófanos, aunque es poca la evidencia que los respalda.
Dentro de los sistemas de calentamiento pasivos, se encuentran los guantes, la ropa, sabanas de algodón, cubrecabezas, líquidos tibios en extremidades, lo cual debe realizarse entre 40 a 60 minutos previos a la inducción anestésica (11).
La paciente tenía antecedentes positivos para sospechar clínicamente que presentara un FR, debido a su color de piel, no se evidencio claramente el cambio de color trifásico de los dedos que describe la literatura secundario a las fases isquémica y de desoxigenación que presenta este fenómeno, por lo cual para asegurar una onda de plestimografía confiable, nos valimos de medios físicos como líquidos tibios intravenosos y al contacto en extremidades superiores, múltiples mantas térmicas, sistema de aire forzado caliente y tres oxímetros para comparar las puntuaciones; con lo cual se logró registrar una saturación de 98-100 %, en el tiempo en que la paciente se encontró despierta. En el periodo intraoperatorio bajo estas medidas se logró mantener el registro y el procedimiento se realizó sin complicaciones.
Adicional, la hipotermia no solo influye en la curva de plestimografía para la cuantificación de la saturación de oxígeno ante el FR; como anestesiólogos se debe tener en cuenta los medicamentos que usamos ya sea para la inducción o el mantenimiento anestésico. Un grupo importante son los opioides, en este caso se administró remifentanilo, que por condiciones de hipotermia puede incrementan su concentración plasmática en un 25 % (12).
El FR es una entidad para tener en cuenta dentro de la evaluación preoperatoria, porque se asocia a varias enfermedades importantes, que pueden tener repercusiones con la anestesia. No debemos olvidar que la hipotermia puede interferir en la farmacodinamia de los medicamentos que utilizamos durante el acto anestésico y aumentar el riesgo de complicaciones.
Conflicto de intereses: Autores declaran no tener conflicto de intereses. Apoyo financiero y patrocinio: Ninguno
Referencias:
- Temprano KK. A Review of Raynaud’s Disease. Mo Med. 2016;113(2):123-6
- Wigley FM. Raynaud’s phenomenon. N Engl J Med. 2002;347(13):1001-8. doi: 10.2217/ijr.10.17
- Sony S, Shekhar S, Walikar BN, Shiwali S. Raynaud’s phenomenon during non-operating room anesthesia: A case report. Cureus 2022;14(12):e32906. DOI: 10.7759/cureus.32906
- Rodríguez-Criollo JA, Jaramillo-Arroyave D. Fenómeno de Raynaud. Revisión. Rev Fac Med. 2014;62(3):1-24. http://dx.doi.org/10.15446/revfacmed.v62n3.38934
- Kahaleh MB, Fan PS. Mechanism of serum-mediated endothelial injury in scleroderma: identification of a granular enzyme in scleroderma skin and sera. Clin Immunol Immunopathol. 1997;83(1):32-40. https://doi.org/10.1006/clin.1996.4322
- Sgonc R, Gruschwitz MS, Boeck G, Sepp N, Gruber J, Wick G. Endothelial cell apoptosis in systemic sclerosis is induced by antibody‐dependent cell‐mediated cytotoxicity via CD95. Arthritis Rheum Off J Am Coll Rheumatol. 2000;43(11):2550-62. https://doi.org/10.1002/1529-0131(200011)43:11%3C2550::AID-ANR24%3E3.0.CO;2-H
- Joven BE, Carreira PE. Síndrome de Raynaud: etiología y manejo. Reumatol Clínica. 2008;4(2):59-66. DOI: 10.1016/S1699-258X(08)71801-1
- Tomaino MM, Goitz RJ, Medsger TA. Surgery for ischemic pain and Raynaud’s’ phenomenon in scleroderma: a description of treatment protocol and evaluation of results. Microsurg Off J Int Microsurg Soc Eur Fed Soc Microsurg. 2001;21(3):75-9. https://doi.org/10.1002/micr.1013
- Poveda V de B, Martinez EZ, Galvão CM. Métodos activos de calentamiento cutáneo para la prevención de hipotermia en el período intraoperatorio: revisión sistemática. Rev Lat Am Enfermagem. 2012;20:183-91. https://doi.org/10.1590/S0104-11692012000100024
- Galvão CM, Liang Y, Clark AM. Effectiveness of cutaneous warming systems on temperature control: meta‐analysis. J Adv Nurs. 2010;66(6):1196-206. https://doi.org/10.1111/j.1365-2648.2010.05312.x
- Uriostegui-Santana ML, Nava-López JA, Mendoza-Escoto VM. Alteraciones de la temperatura y su tratamiento en el perioperatorio. Rev Mex Anestesiol 2017;40(1).
- Sessler DI. Perianesthetic thermoregulation and heat balance in humans. FASEB J. 1993;7(8):638-44. https://doi.org/10.1096/fasebj.7.8.8500688.
