Apartados
Resumen
Abstract
Introducción
Conclusión
Referencias
Gustavo Adolfo Beas Magdaleno1, Silver Balcázar De León2, Luz Marina Sotelo Valenzuela3. 1Anestesiólogo, Especialista en Dolor y Cuidados Paliativos, Hospital San Javier, Guadalajara, Jalisco, México. 2Anestesiólogo, Especialista en Dolor y Cuidados Paliativos, Centro Médico del Dolor, Monterrey, Nuevo León. 3Anestesiólogo, Especialista en Dolor y Cuidados Paliativos, Hospital Nacional Edgardo Rebagliati Martins, Lima, Perú.
Anestesia en México 2026;38(1): 30-39. https://doi.org/10.64221/aem-38-1-2026-005
Fecha de recepción: Julio 2025, fecha de revisión, septiembre 2025, fecha de publicación enero 2026.
gbm90@outlook.com
Palabras clave. Palmitoiletanolamida, endocannabinoides, dolor crónico, tratamiento, evidencia.
Abstract
Keywords: Palmitoylethanolamide, endocannabinoids, chronic pain, treatment, evidence.
Introducción
El dolor crónico en diversas patologías tiene una etiología poco clara, pero existe consenso de la interacción de factores biológicos, psicológicos y sociales (3). El dolor crónico se clasifica según su etiología en dolor crónico primario, cuya causa no está clara; dolor crónico secundario que ocurre cuando el dolor es un síntoma de una afección subyacente, y otros factores como la sensibilización central, factores psicológicos e influencias ambientales (4).
El dolor crónico representa una enorme carga personal y económica y afecta a más del 30% de la población mundial, con tasas de prevalencia que varían entre el 11 % y el 40 % (5). En el Reino Unido, por ejemplo, el dolor crónico afecta a entre el 13 y 50 % de los adultos, y de estos, entre el 10.4 y el 14.3 % presentan dolor crónico incapacitante de moderado a severo (6).
En México, los datos del Instituto Nacional de Estadística y Geografía indican que entre el 25 y 27 % de la población sufre algún tipo de dolor, de los cuales los que reciben tratamiento para dolor crónico es el 14 % (7).
Las personas con dolor crónico muestran percepciones desfavorables de la salud, creencias negativas para afrontar el dolor, angustia psicológica, ansiedad, depresión e interferencia en las actividades generales, lo que disminuye su calidad de vida (8). Por otro lado, el impacto económico del dolor crónico es grande por los gastos en medicamentos para controlarlo o por la incapacidad de trabajar (9).
El tratamiento del dolor crónico es importante debido a sus efectos sobre el bienestar individual, la salud social y la estabilidad económica (10). Un tratamiento eficaz puede mejorar la calidad de vida, restablecer la funcionalidad y reducir la carga sobre los sistemas de atención sanitaria y la sociedad en su conjunto (11). En este estudio, se revisa la evidencia actual sobre el uso de palmitoiletanolamida para el manejo del dolor crónico.
En el dolor crónico, el término sensibilización central indica que las neuronas de la médula espinal se vuelven hiperexcitables con el tiempo después de una lesión (14). La sensibilización central puede mantenerse con o sin estímulos periféricos continuos, como resultado de cambios químicos, estructurales y funcionales en el sistema nervioso central que conducen en última instancia a un estado persistente y aumentado de reactividad neuronal (15). En este estado fisiopatológico, el sistema nervioso central está hiperexcitado incluso en ausencia de estímulos sensoriales (15). Esta amplificación a menudo conduce a dolor crónico, generalizado y migratorio, fatiga crónica, hiperreactividad sensorial y muchos otros síntomas (15).
Por lo tanto, los pacientes con sensibilización central pueden percibir dolor de estímulos normalmente no dolorosos (alodinia) y experimentar mayor dolor de estímulos dolorosos (hiperalgesia) (15). Las neuronas afectadas pueden tener actividad autónoma espontánea, umbrales más bajos para la activación o el dolor y campos receptivos más amplios (15).
El sistema endocannabinoide (SEC) modula funciones fisiológicas críticas como el dolor, la saciedad, el miedo, la memoria y la inflamación (16). Los principales objetivos de este incluyen el cerebro, la médula espinal, los adipocitos, los hepatocitos, las células endoteliales y el sistema inmunológico (16).
El SEC está integrado por moléculas lipídicas bioactivas denominadas endocannabinoides (o cannabinoides endógenos), las enzimas responsables de su biosíntesis y degradación, y los receptores endocannabinoides que impulsan su señalización descendente constituyen esencialmente el SEC (17). Los principales endocannabinoides son: 1. La N-araquidoniletanolamina (AEA) o anandamida [que fue el primer endocannabinoide descubierto a partir de extractos de cerebro porcino], 2. El 2-araquidonilglicerol (2-AG) [aislado por primera vez del intestino canino y está presente en una concentración 170 veces mayor que la anandamida en el lisado cerebral] y 3. Otros como el éter de noladina, virodamina y la N-araquidonoil dopamina (18) (Figura 1).
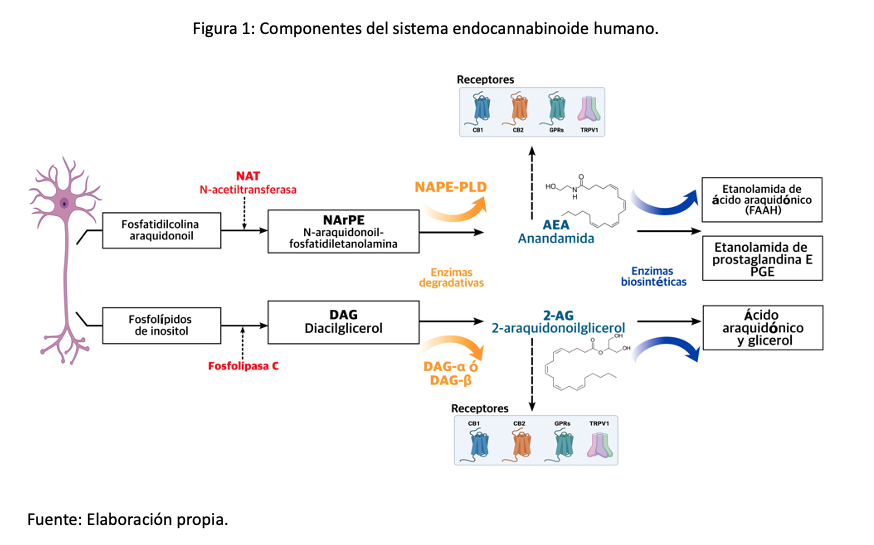
La unión de los endocannabinoides a los receptores CB1 y CB2 produce un efecto inhibidor neto sobre la actividad celular a través de varios mecanismos, incluida la inhibición de la formación de AMPc mediada por la adenilil ciclasa y la modulación de los canales de potasio y calcio; ello reduce la transmisión de señales de dolor (25).
Por otro lado, los endocannabinoides actúan en las células inmunes suprimiendo la liberación de citocinas proinflamatorias y reduciendo el dolor inflamatorio (26). Los endocannabinoides también interactúan con otros receptores, como el receptor de potencial transitorio vanilloide 1 (TRPV1), que influye en la percepción del dolor (26).
Se ha identificado una desregulación del SEC en condiciones como la fibromialgia, el dolor neuropático, la migraña y enfermedades inflamatorias (27). Se ha establecido que el dolor crónico, al menos en parte, surge de deficiencias en los niveles de endocannabinoides, lo que conduce a una regulación deficiente del dolor (28). En el dolor crónico, la microglia y los astrocitos son clave en el desarrollo y mantenimiento del dolor; la microglía es la primera en activarse tras una lesión nerviosa o inflamación y como resultado libera factores como TNF-α e IL-1β, que activan a los astrocitos perpetuando la respuesta inflamatoria y conduciendo a dolor crónico(29). Por el contrario, la activación de CB2 reduce la activación glial y la neuroinflamación mediante reducción de la liberación de glutamato y citocinas proinflamatorias como TNF-α, IL-1β e IL-6(30).
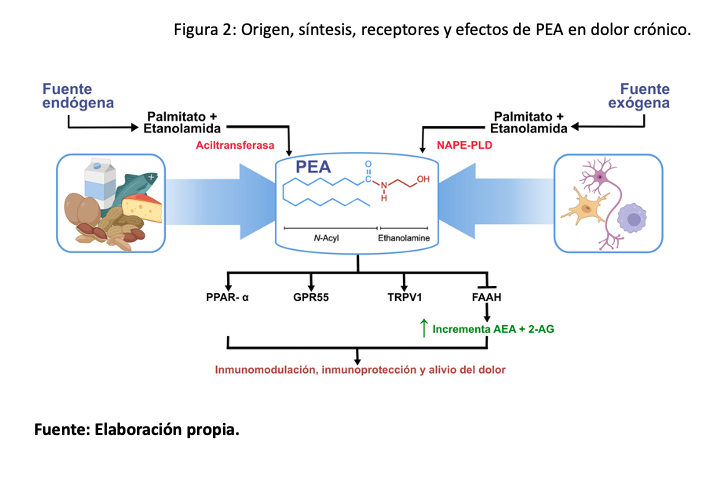
En humanos, la biosíntesis de PEA ocurre a través de la hidrólisis de su precursor fosfolípido directo, N-palmitoil-fosfatidil-etanolamina, por la acción de la NAPE-PLD, muy similar a la síntesis de AEA (33). Pero la PEA también puede obtener a partir de la leche, huevo, frijol, jitomate, maíz, soya, cacahuate y alimentos similares (33). El aislamiento de la PEA se realiza como cualquier otro lípido, mediante extracción con solventes orgánicos como hexano, fraccionamiento mediante cromatografías y purificación (34). La síntesis química parte de ácido palmítico y etanolamina en donde se debe formar un enlace amida entre el grupo carboxilo del ácido palmítico y el grupo amina de la etanolamina (35). Esto se logra a través de reacciones de condensación o amidación con subsecuente purificación mediante recristalización o cromatografía (36).
La PEA se produce como una respuesta protectora a lesiones, inflamación y dolor (37). Sin embargo, cuando el dolor es prolongado, puede desarrollarse un «agotamiento» de la PEA (37), en consecuencia, en condiciones inflamatorias crónicas se presentan niveles más bajos de PEA (38), por lo que la administración exógena puede ayudar a reponer los niveles de PEA endógena, restaurando sus efectos protectores, antiinflamatorios y analgésicos (38).
La PEA actúa directamente sobre los receptores PPAR-α y GPR55 e indirectamente sobre los receptores CB1, CB2 y TRPV (39). Suprime la inflamación al regular a la baja mediadores como las enzimas ciclooxigenasas, citocinas proinflamatorias (TNF-α, IL-1β e IL-6) e inhibe la activación de la microglía, los astrocitos y la liberación de glutamato que participan en la fisiopatología del dolor crónico (39) (Figura 2).
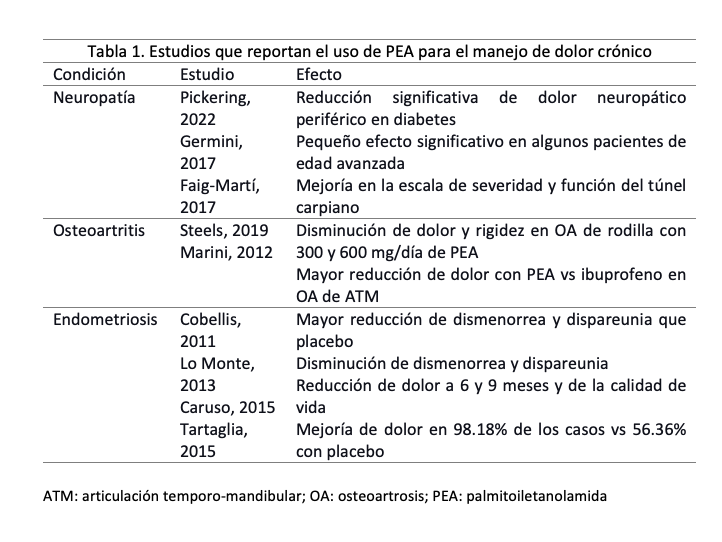
Marini et al. (2012) compararon 300 mg de PEA en la mañana más 600 mg en las noches por siete días; y posteriormente 300 mg cada 12 horas por otros siete días; versus 600 mg de ibuprofeno en pacientes con artrosis de la articulación temporomandibular. Encontraron una disminución del dolor a las 2 semanas en ambos grupos, pero la reducción fue significativamente mayor con PEA (43). Germini et al. (2017) compararon PEA 600 mg cada 12 horas con placebo dos veces al día por dos semanas para tratamiento de dolor crónico en pacientes geriátricos; encontraron una reducción leve pero estadísticamente significativa en pacientes que recibieron PEA (44). Faig-Martí et al. (2017) administraron PEA 300 mg cada 12 horas durante 60 días versus placebo cada 12 horas en pacientes con síndrome de túnel carpiano. No encontraron diferencias significativas en dolor, pero si una disminución de la gravedad de los síntomas y mejoría funcional evaluados con el Cuestionario de Boston (45). Ottaviani et al. (2019) compararon PEA 600 mg cada 12 hora versus placebo dos veces al día durante 60 días en pacientes con síndrome de boca ardiente [caracterizado por dolor neuropático crónico] encontrando una reducción significativa de los síntomas en el grupo PEA comparado con el placebo (46). Pickering et al. (2022) compararon 600 mg de PEA diariamente, durante ocho semanas versus placebo en pacientes diabéticos con neuropatía periférica (ND) encontrando una reducción significativa del dolor neuropático evaluado con escalas específicas para ND y para cualquier tipo de dolor neuropática; esto acompañado de reducción de inflamación y mejoría del estado de ánimo y el sueño (47). Steels et al. (2019) compararon 300 mg de PEA diarios versus 600 mg de PEA diarios versus placebo durante ocho semanas en pacientes con osteoartritis de rodilla. Ambas dosis de PEA redujeron significativamente el dolor, la rigidez, síntomas de ansiedad y mejoraron la funcionalidad; además, el medicamento fue bien tolerado (48). Por su parte, Andresen et al. (2016) compararon 600 mg de PEA ultramicronizada cada 12 horas versus placebo para dolor neuropático relacionado con lesión de médula espinal; aunque no observaron diferencia significativa en la intensidad del dolor entre grupos y no hubo eventos adversos relacionados con el tratamiento (49).
Por tanto, la evidencia encontrada sobre la eficacia de PEA para el dolor crónico muestra resultados prometedores. Los estudios cuasiexperimentales demuestran que la PEA es eficaz para el tratamiento de dolor en endometriosis y mejora la calidad de vida, sin efectos adversos. En los ensayos clínicos en que se evaluó la eficacia de PEA sola se demostraron resultados positivos en condiciones que cursan con dolor crónico de múltiples etiologías. Entre otros resultados, se han encontrado efectos similares a terapias analgésicas estándar, efectos superiores a ibuprofeno en artrosis temporomandibular y reducciones significativas de dolor crónico geriátrico, síndrome de boca ardiente, neuropatía diabética y osteoartritis de rodilla. La dosis efectiva en estas condiciones oscila entre 300 mg y 600 mg cada 12 horas. Sin embargo, los resultados fueron mixtos o neutros en síndrome del túnel carpiano (donde mostró mejoría funcional pero no del dolor) y sin respuesta en el dolor neuropático por lesión medular.
Por otro lado, estudios clínicos con PEA combinada también mostraron resultados positivos en prostatitis crónica/dolor pélvico, vulvodinia (en combinación con TENS), dismenorrea primaria, síndrome del intestino irritable y dolor de origen central por esclerosis múltiple y endometriosis. La dosis efectiva es de 300-600 mg/día, con duraciones de tratamiento de entre dos y 12 semanas. Por tanto, la evidencia sugiere mayor efectividad de la PEA combinada en dolor neuropático, musculoesquelético y pélvico/ginecológico. Además, es evidente que el perfil de seguridad de la PEA es favorable, siendo generalmente bien tolerado y con escasos efectos adversos reportados. La PEA demuestra ser eficaz tanto en monoterapia como en combinación para el tratamiento de dolor crónico, representando una alternativa viable a tratamientos convencionales, especialmente en poblaciones que requieren opciones seguras como ancianos o pacientes con comorbilidades (Figura 2).
Conflicto de interés. Ninguno que declarar. Financiamiento. Ninguna fuente de financiamiento.
Referencias:
2. Treede RD, Rief W, Barke A, Aziz Q, Bennett MI, Benoliel R, et al. Chronic pain as a symptom or a disease: the IASP Classification of Chronic Pain for the International Classification of Diseases (ICD-11). Pain. 2019;160(1):19–27. doi: 10.1097/j.pain.0000000000001384.
3. Linton SJ, Flink IK, Vlaeyen JWS. Understanding the etiology of chronic pain from a psychological perspective. Phys Ther. 2018;98(5):315-324. doi: 10.1093/ptj/pzy027.
4. Treede RD, Rief W, Barke A, Aziz Q, Bennett MI, Benoliel R, et al. A classification of chronic pain for ICD-11. Pain. 2015; 156(6):1003–7. DOI: 10.1097/j.pain.0000000000000160
5. Cohen SP, Vase L, Hooten WM. Chronic pain: an update on burden, best practices, and new advances. The Lancet. 2021; 397(10289):2082–97. DOI: 10.1016/S0140-6736(21)00393-7
6. Mills SEE, Nicolson KP, Smith BH. Chronic pain: a review of its epidemiology and associated factors in population-based studies. Br J Anaesth. 2019;123(2):e273–83. DOI: 10.1016/j.bja.2019.03.023
7. Liñeiro MG, Santos Garcia JB, Narváez Tamayo MA, et al. Map of pain education in Latin America: current state and perspectives. Pain Manag. 2023;13(3):193-199. doi:10.2217/pmt-2022-0102 DOI: 10.2217/pmt-2022-0102
8. Von Korff M, DeBar LL, Krebs EE, Kerns RD, Deyo RA, Keefe FJ. Graded chronic pain scale revised: mild, bothersome, and high-impact chronic pain. Pain. 2020;161(3):651–61. DOI: 10.1097/j.pain.0000000000001758
9. Sovaila S, Purcarea A, Neculau A. Chronic pain, a narrative review for the internist in 2024. Romanian Journal of Internal Medicine. 2024;62(2):124–37. DOI: 10.2478/rjim-2023-0035
10. Danilov A, Danilov A, Barulin A, Kurushina O, Latysheva N. Interdisciplinary approach to chronic pain management. Postgrad Med. 2020;132(sup3):5–9. DOI: 10.1080/00325481.2020.1757305
11. Knopp-Sihota JA, MacGregor T, Reeves JTH, Kennedy M, Saleem A. Management of Chronic Pain in Long-Term Care: A Systematic Review and Meta-Analysis. J Am Med Dir Assoc. 2022; 23(9):1507-1516.e0. DOI: 10.1016/j.jamda.2022.04.008
12. Kang Y, Trewern L, Jackman J, McCartney D, Soni A. Chronic pain: definitions and diagnosis. BMJ. 2023; e076036. DOI: 10.1136/bmj-2023-076036
13. Montiel DA, Castillo ÁA. El dolor desde la perspectiva del estudiante de medicina: una revisión del concepto, fisiopatología, clasificación, taxonomia y herramientas para su medición. Archivos en Medicina Familiar. 2021;23(3):157–62.
14. Allegri M, Clark MR, De Andrés J, Jensen TS. Acute and chronic pain: where we are and where we have to go. Minerva Anestesiol. 2012;78(2):222–35.
15. Volcheck MM, Graham SM, Fleming KC, Mohabbat AB, Luedtke CA. Central sensitization, chronic pain, and other symptoms: Better understanding, better management. Cleve Clin J Med. 2023; 90(4):245–54. DOI: 10.3949/ccjm.90a.22019
16. Busquets-García A, Bolaños JP, Marsicano G. Metabolic messengers: endocannabinoids. Nat Metab. 2022;4(7):848–55. DOI: 10.1038/s42255-022-00600-1
17. Lannotti FA. Cannabinoids, Endocannabinoids, and Synthetic Cannabimimetic molecules in neuromuscular disorders. Int J Mol Sci. 2023; 25(1):238. DOI: 10.3390/ijms25010238
18. Suchopár J, Laštůvka Z, Mašková S, Alblová M, Pařízek A. Endocannabinoids. Ceska Gynekol. 2021; 86(6):414–20. DOI: 10.48095/cccg2021414
19. Simard M, Archambault AS, Lavoie JPC, Dumais É, Di Marzo V, Flamand N. Biosynthesis and metabolism of endocannabinoids and their congeners from the monoacylglycerol and N-acyl-ethanolamine families. Biochem Pharmacol. 2022;205:115261. DOI: 10.1016/j.bcp.2022.115261
20. Rahaman O, Ganguly D. Endocannabinoids in immune regulation and immunopathologies. Immunology. 2021;164(2):242–52. DOI: 10.1111/imm.13378
21. Rodrigues RJ, Marques JM, Köfalvi A. Cannabis, Endocannabinoids and Brain Development: From Embryogenesis to Adolescence. Cells. 2024;13(22):1875. DOI: 10.3390/células13221875
22. Lu HC, Mackie K. An Introduction to the endogenous cannabinoid system. Biol Psychiatry. 2016;79(7):516–25. DOI: 10.1016/j.biopsych.2015.07.028
23. Lu HC, Mackie K. Review of the Endocannabinoid system. Biol Psychiatry Cogn Neurosci Neuroimaging. 2021;6(6):607–15. DOI: 10.1016/j.bpsc.2020.07.016
24. Hameed M, Prasad S, Jain E, Dogrul BN, Al-Oleimat A, Pokhrel B, et al. Medical cannabis for chronic nonmalignant pain management. Curr Pain Headache Rep. 2023;27(4):57–63. DOI: 10.1007/s11916-023-01101-w
25. Blanton HL, Barnes RC, McHann MC, Bilbrey JA, Wilkerson JL, Guindon J. Sex differences and the endocannabinoid system in pain. Pharmacol Biochem Behav. 2021;202:173107. DOI: 10.1016/j.pbb.2021.173107
26. Rezende B, Alencar AKN, de Bem GF, Fontes-Dantas FL, Montes GC. Endocannabinoid system: chemical characteristics and biological activity. Pharmaceuticals. 2023;16(2):148. DOI: 10.3390/ph16020148
27. Greco R, Demartini C, Zanaboni AM, Francavilla M, De Icco R, Ahmad L, et al. The endocannabinoid system and related lipids as potential targets for the treatment of migraine‐related pain. Headache: The Journal of Head and Face Pain. 2022;62(3):227–40. DOI: 10.1111/cabeza.14267
28. Zieglgänsberger W, Brenneisen R, Berthele A, Wotjak CT, Bandelow B, Tölle TR, et al. Chronic pain and the endocannabinoid system: smart lipids – A novel therapeutic option? Med Cannabis Cannabinoids. 2022;5(1):61–75. DOI: 10.1159/000522432
29. Lu HJ, Gao YJ. Astrocytes in chronic pain: cellular and molecular mechanisms. Neurosci bull. 2022;39(3):425. DOI: 10.1007/s12264-022-00961-3
30. Anthony AT, Rahmat S, Sangle P, Sandhu O, Khan S. Cannabinoid receptors and their relationship with chronic pain: A narrative review. Cureus. 2020;12(9):e10436. DOI: 10.7759/cureus.10436
31. Lambert D, Vandevoorde S, Jonsson KO, Fowler C. The palmitoylethanolamide family: A new class of anti-Inflammatory agents? Curr Med Chem. 2002;9(6):663–74. DOI: 10.2174/0929867023370707
32. Rankin L, Fowler CJ. The basal pharmacology of palmitoylethanolamide. Int J Mol Sci. 2020;21(21):7942. DOI: 10.3390/ijms21217942
33. Petrosino S, Di Marzo V. The pharmacology of palmitoylethanolamide and first data on the therapeutic efficacy of some of its new formulations. Br J Pharmacol. 2017;174(11):1349–65. DOI: 10.1111/bph.13580
34. Gunawan ER, Suhendra D, NuansaWindari B, Kurniawati L. Enzymatic synthesis of palmitoylethanolamide from ketapang kernel oil. J Phys Conf Ser. 2019; 1(2): 022034. DOI: 10.1088/1742-6596/1321/2/022034
35. Chemical Book 2016 Palmitoylethanolamide synthesis. Disponible en: https://www.chemicalbook.com/synthesis/palmitoylethanolamide.htm
36. Vacondio F, Bassi M, Silva C, Castelli R, Carmi C, Scalvini L, et al. Amino acid derivatives as palmitoylethanolamide prodrugs: synthesis, In vitro metabolism and In vivo plasma profile in Rats. PLoS One. 2015;10(6):e0128699. DOI: 10.1371/journal.pone.0128699
37. Lang-Illievich K, Klivinyi C, Lasser C, Brenna CTA, Szilagyi IS, Bornemann-Cimenti H. Palmitoylethanolamide in the treatment of chronic pain: A systematic review and meta-analysis of double-Blind randomized controlled trials. Nutrients. 2023;15(6):1350. DOI: 10.3390/nu15061350
38. Clayton P, Hill M, Bogoda N, Subah S, Venkatesh R. Palmitoylethanolamide: A natural compound for health management. Int J Mol Sci. 2021;22(10):5305. DOI: 10.3390/ijms22105305
39. Varrassi G, Rekatsina M, Leoni MLG, Cascella M, Finco G, Sardo S, et al. A decades-long journey of palmitoylethanolamide (PEA) for chronic neuropathic pain management: A comprehensive narrative review. Pain Ther. 2024 Dec 4; DOI: 10.1007/s40122-024-00685-4
40. Lo Monte G, Soave I, Marci R. [Administration of micronized palmitoylethanolamide (PEA)-transpolydatin in the treatment of chronic pelvic pain in women affected by endometriosis: preliminary results]. Minerva Ginecol. 2013;65(4):453–63.
41. Caruso S, Iraci Sareri M, Casella E, Ventura B, Fava V, Cianci A. Chronic pelvic pain, quality of life and sexual health of women treated with palmitoylethanolamide and α-lipoic acid. Minerva Ginecol. 2015;67(5):413–9.
42. Gatti A, Lazzari M, Gianfelice V, Di Paolo A, Sabato E, Sabato AF. Palmitoylethanolamide in the treatment of chronic pain caused by different etiopathogenesis. Pain Medicine. 2012;13(9):1121–30. DOI: 10.1111/j.1526-4637.2012.01432.x
43. Marini I, Bartolucci ML, Bortolotti F, Gatto MR, Bonetti GA. Palmitoylethanolamide versus a nonsteroidal anti-inflammatory drug in the treatment of temporomandibular joint inflammatory pain. J Orofac Pain. 2012;26(2):99–104.
44. Germini F, Coerezza A, Andreinetti L, Nobili A, Rossi PD, Mari D, et al. N-of-1 randomized trials of ultra-micronized palmitoylethanolamide in older patients with chronic pain. Drugs Aging. 2017;34(12):941–52. DOI: 10.1007/s40266-017-0506-2
45. Faig-Martí J, Martínez-Catassús A. Use of palmitoylethanolamide in carpal tunnel syndrome: a prospective randomized study. Journal of Orthopaedics and Traumatology. 2017;18(4):451–5. DOI: 10.1007/s10195-017-0453-z
46. Ottaviani G, Rupel K, Gobbo M, Poropat A, Zoi V, Faraon M, et al. Efficacy of ultramicronized palmitoylethanolamide in burning mouth syndrome-affected patients: a preliminary randomized double-blind controlled trial. Clin Oral Investig. 2019;23(6):2743–50. DOI: 10.1007/s00784-018-2720-7
47. Pickering E, Steels EL, Steadman KJ, Rao A, Vitetta L. A randomized controlled trial assessing the safety and efficacy of palmitoylethanolamide for treating diabetic-related peripheral neuropathic pain. Inflammopharmacology. 2022;30(6):2063–77. DOI: 10.1007/s10787-022-01033-8
48. Steels E, Venkatesh R, Steels E, Vitetta G, Vitetta L. A double-blind randomized placebo controlled study assessing safety, tolerability and efficacy of palmitoylethanolamide for symptoms of knee osteoarthritis. Inflammopharmacology. 2019;27(3):475–85. DOI: 10.1007/s10787-019-00582-9
49. Andresen SR, Bing J, Hansen RM, Biering-Sørensen F, Johannesen IL, Hagen EM, et al. Ultramicronized palmitoylethanolamide in spinal cord injury neuropathic pain: a randomized, double-blind, placebo-controlled trial. Pain. 2016;157(9):2097–103. DOI: 10.1097/j.pain.0000000000000623
50. Cobellis L, Castaldi MA, Giordano V, Trabucco E, De Franciscis P, Torella M, et al. Effectiveness of the association micronized N-Palmitoylethanolamine (PEA)–transpolydatin in the treatment of chronic pelvic pain related to endometriosis after laparoscopic assessment: a pilot study. European Journal of Obstetrics end Gynecology and Reproductive Biology. 2011;158(1):82–6. DOI: 10.1016/j.ejogrb.2011.04.011
51. Giammusso B, Di Mauro R, Bernardini R. The efficacy of an association of palmitoylethanolamide and alpha-lipoic acid in patients with chronic prostatitis/chronic pelvic pain syndrome: A randomized clinical trial. Archivio Italiano di Urologia e Andrologia. 2017;89(1):17. DOI: 10.4081/aiua.2017.1.17
52. Murina F, Graziottin A, Felice R, Radici G, Tognocchi C. Vestibulodynia: synergy between palmitoylethanolamide + transpolydatin and transcutaneous electrical nerve stimulation. J Low Genit Tract Dis. 2013;17(2):111–6. DOI: 10.1097/LGT.0b013e3182652316
53. Tartaglia E, Armentano M, Giugliano B, Sena T, Giuliano P, Loffredo C, et al. Effectiveness of the association N-palmitoylethanolamine and transpolydatin in the treatment of primary dysmenorrhea. J Pediatr Adolesc Gynecol. 2015;28(6):447–50. DOI: 10.1016/j.jpag.2014.12.011
54. Orefice NS, Alhouayek M, Carotenuto A, Montella S, Barbato F, Comelli A, et al. Oral palmitoylethanolamide treatment Is associated with reduced cutaneous adverse effects of interferon-β1a and circulating proinflammatory cytokines in relapsing–remitting multiple sclerosis. Neurotherapeutics. 2016;13(2):428–38. DOI: 10.1007/s13311-016-0420-z
55. Cremon C, Stanghellini V, Barbaro MR, Cogliandro RF, Bellacosa L, Santos J, et al. Randomised clinical trial: the analgesic properties of dietary supplementation with palmitoylethanolamide and polydatin in irritable bowel syndrome. Aliment Pharmacol Ther. 2017;45(7):909–22. DOI: 10.1111/apt.13958
