Apartados
Resumen
Abstract
Introducción
Conclusión
Referencias
1Alemán-Vargas I, medico Anestesiólogo del Instituto Mexicano del Seguro Social, Supervisor de Hospitales de la OOAD IMSS, Sinaloa, México.
Anestesia en México 2026;38(1): 40-51. https://doi.org/10.64221/aem-38-1-2026-006
Fecha de recepción octubre 2025, fecha de revisión noviembre 2025, fecha de publicación Enero 2026
isabel.aleman@imss.gob.mx
Palabras clave: vía aérea, vía área difícil, escala de valoración vía aérea pediátrica.
Abstract
Keywords: airway, difficult airway, pediatric airway assessment scale.
Introducción
La ventilación difícil (VD) con mascarilla facial (MF) durante una inducción anestésica de rutina o durante una sedación en un niño menor de ocho años, puede ser complicada. Si no se resuelve rápidamente puede traer consecuencias catastróficas. Toma importancia especialmente pensando en aquellos anestesiólogos cuyo trabajo con niños es esporádico, de tal manera que podamos disminuir el estrés del anestesiólogo aplicando algunos conceptos básicos y avanzados. Desgraciadamente no hay una prueba clínica o de gabinete única o una combinación de ambas, que puedan ser aplicadas universalmente, la mayoría de las escalas conocidas en pediatría tuvieron su origen en pacientes adultos (1).
La VD se define como la incapacidad del personal entrenado para mantener la saturación de oxígeno por arriba del 90 % usando MF, con una fracción inspirada de oxígeno de 100 %. La intubación difícil (ID) se define como la necesidad de tres o más intentos para la intubación de la tráquea o más de diez minutos para conseguirla. Es trascendental recordar que, a mayor grado de dificultad de la VA, mayor incidencia y severidad de las complicaciones serán presentadas (2). La dificulta para ventilar una VADNA, usualmente resulta de la obstrucción dinámica y responde favorablemente a la pronta y adecuada intervención por parte del anestesiólogo. Esta obstrucción dinámica puede ser en general clasificada como, obstrucción supraglótica, glótica o infraglótica.
En este escrito se exponen las variables y características clínicas que afectan la funcionalidad de la VA Superior e inferior en el infante de acuerdo con la presencia de enfermedades genéticas, congénitas y alteraciones anatómicas. (En la tabla 1) se describe las situaciones clínicas que predisponen una VAD

Actualmente no se cuenta con estudios de la VA realizados en urgencias y en especial los que analizan factores predictores de dificultad. Tampoco existe una escala de manera específica para la edad pediátrica, pues la mayoría están clasificadas para el paciente adulto, no obstante, las escalas son de utilidad en el quehacer diario de todo médico que maneja la VA, ya que es mejor prever y/o anticipar una VAD en lugar que se presente de forma inesperada o no anticipada. Debido a esto en este presente escrito se propone una escala clínica de la VA pediátrica basada en los cambios anatómicos de cara, cuello y estructuras orofaríngeas según la edad pediátrica, los principales síndromes congénitos craneofaciales y las enfermedades sino-bronquiales.
Ya se ha mencionado que como causa directa de morbilidad se encuentra la intubación difícil, ventilación inadecuada, apnea y obstrucción bronquial. La mayor parte de estas complicaciones son evitables y al ser auditadas durante las demanda médico-legales se han encontrado la siguiente problemática de tipo de infraestructura física, equipamiento médico y manejo del entorno complicado; ha sido la falla de reconocer o anticiparse a los problemas por inadecuada planeación de la VA, revisión inadecuada de máquina de anestesia y monitores de signos vitales con falta de insumos y consumibles (omisión e imprudencia en la praxis médica), escasa vigilancia de acuerdo a la NOM-006-SSA3-2012 y preparación insuficiente frente a situaciones adversas (impericia).
Las diferencias Anatómicas de la VA son un pilar angular para el manejo adecuado y correcto de la VA pediátrica. Presentan un amplio espectro de enfermedades, tanto congénitas como adquiridas que pueden repercutir en la VA, dificultando la intubación y/o ventilación. Las diferencias entre la VA de un niño y de un adulto son de gran importancia para el manejo anestésico. Los recién nacidos y los lactantes son el grupo que presentan las mayores diferencias anatómica de la VA (3).
Las diferencias están en las fosas nasales las cuales son pequeñas y las constituyen la principal ruta de ventilación, durante los primeros seis meses de vida, la lengua es relativamente grande, las amígdalas prominentes, la laringe es pequeña y está posicionada más cefálica quedando la apertura glótica a nivel de C3-C4 (ésta llega C5 a los seis años). La epiglotis del niño es más corta en forma de omega y blanda que la del adulto, forma un ángulo de unos 45 grados con la base de la lengua, en comparación a los 15-25 grados del adulto. Los cartílagos aritenoides son grandes comparados con la apertura glótica y hay una reducción progresiva del tamaño del hioides al cricoides y la forma de la laringe es cónica. La parte más estrecha de la laringe está a nivel del cartílago cricoides. Estas características pueden dificultar el paso del tubo orotraqueal. Es importante recordar que los lactantes tienen la cabeza y el promontorio occipital más grande, siendo el cuello relativamente corto. Esto produce una flexión cervical por lo que impide la extensión de la cabeza o posición de olfateo “sniffing position”, para corregir este ángulo de flexión se coloca un bulto cilíndrico de unos 10 cm sobre el borde de los hombros para ayudar a extender la cabeza y lograr la posición de olfateo durante la ventilación e intubación (3).
Otro punto diferencial entre ambos grupos de edad son las variables fisiológicas como lo son el consumo de oxígeno mayor y menos reserva de oxígeno (CRF) en los lactantes y niños pequeños. Así como también la distensión gástrica, frecuente cuando son ventilados con mascarilla facial, eleva el diafragma disminuyendo aún más la CRF y la reserva de oxígeno. También disminuye la compliance pulmonar, lo que interfiere con la ventilación a presión positiva, aumentando el riesgo de regurgitación y aspiración. Los niños son más susceptibles a la obstrucción de VA debido a la mayor sensibilidad de ciertos músculos inspiratorios frente a los agentes anestésicos. La instrumentación de la VA durante la intubación orotraqueal (IOT) puede gatillar un broncoespasmo; Los niños son más susceptibles a la obstrucción de la VA debido a que el epitelio subglótico es de tipo cilíndrico seudoestratificado que responde ante la manipulación instrumental, inflamación y al incremento brusco de la resistencia al flujo aéreo con efecto de válvula por presión negativa de la VA y progresar a un barotrauma. La Presencia de bradicardia debido a que predomina el sistema nervioso parasimpático. Recordar que la bradicardia es la principal respuesta a la hipoxemia y la frecuencia cardiaca es determinante del gasto cardiaco y que los lactantes menores son dependientes de la frecuencia cardiaca para mantener el gasto cardiaco adecuado, por lo que es importante prestar atención a la presencia de bradicardia y corregir la causa-raíz de su aparición para mantener una buena hemodinamia en el lactante. (2,3)
La VA el infante tiene mayor predisposición al colapso pulmonar debido a la inmadurez de las estructuras laringotraqueobronquiales. En cuanto al árbol traqueobronquial, la diferencia de calibre respecto al adulto condiciona una mayor resistencia al paso del aire, favoreciendo su turbulencia incluso durante la respiración tranquila debido a la mayor laxitud y vascularización de la mucosa, en donde un mínimo de grado de edema, acúmulo de secreciones o broncoespasmo puede aumentar de forma exponencial la resistencia al paso del aire y puede conducir a una obstrucción de la VA rápidamente. El calibre en el adulto es de 8 mm y 4 mm, en el niño en condiciones normales en presencia de edema el calibre en el adulto es de 7 mm y en el niño 3 mm, lo que refleja una disminución de la luz de la VA en un 44 % en el adulto y en un 75 % en el infante.
También la pared torácica es más flexible, con las costillas horizontalizadas, por lo que la respiración y el mantenimiento de la capacidad pulmonar depende en gran medida de la musculatura respiratoria. El infante respira con un menor volumen tidal y mayor frecuencia respiratoria. La menor capacidad residual funcional conllevas menor reserva en apnea y tendencia a hipoventilación. (3)
La musculatura diafragmática e intercostal del neonato y lactante es pobre en miofibrilla tipo I, que permiten los movimientos repetitivos, por lo que cualquier condición que conlleve un aumento del trabajo respiratorio puede conducirles a fatiga muscular y fracaso respiratorio. Existe además menor madurez del centro respiratorio, con menor respuesta a la hipercapnia y variaciones del pH. En definitiva, la eficacia de la ventilación es menor en el niño, especialmente en el lactante pequeño y en el neonato, cuando la comparamos con el adulto. Por ese motivo el infante progresa rápidamente a la hipoxemia (5).
El neonato tiene aumento en el consumo celular de oxígeno debido a su actividad metabólica entre dos a tres veces y ante un cese del suministro de oxígeno, se agotará rápidamente. También presenta mayor capacidad de cierre. El volumen del aire que queda en los alveolos para evitar su colapso se llama volumen o capacidad de cierre. En adultos, este volumen es proporcionalmente menor y coincide con un valor que da dentro de la CRF. En neonatos y lactantes este volumen es mayor, cercano al volumen corriente, es decir, con una mínima reducción del volumen corriente se cierran las pequeñas vías áreas y se forma atelectasias, agravando los problemas de oxigenación y ventilación (2).
Una buena evaluación mediante una historia clínica detallada y el examen físico de cabeza, cuello y columna cervical son importantes para reconocer la VAD Pediátrica.
Se debe incluir los registros de Anestesia previas enfocadas hacia el manejo de la VA, en especial registrar si la ventilación con la mascarilla facial fue posible o no. La presencia de enfermedades congénitas, traumáticas o inflamatorias, que puedan dificultar el manejo de la VA. El conocimiento de los síndromes que afectan la VA es vital para su manejo. La micrognatia, crea más dificultad para desplazar la lengua durante la laringoscopía directa impidiendo observar la glotis, esta situación mejora durante el crecimiento del niño (Síndrome Pierre Robin), en cambio las anomalías por Mucopolisacaridosis como el síndrome Klippel-Feil (Mucopolisacaradosis tipo I) la intubación traqueal se torna más difícil a medida que le niño crece por la rigidez cervical (11).
El interrogatorio y exploración física debe estar orientado a buscar antecedentes o la presencia de ronquidos, estridor, apneas, somnolencia, calidad de fonación y voz, broncoespasmo, enfermedades infecciosas e inflamatorias.
En niños se deben considerar aquellas variables inflamatorias o infecciosas de la VA como la rinitis, bronquitis, bronquiolitis, neumonía, faringitis, laríngotraqueitis, hiperreactividad bronquial y apnea obstructiva del sueño pueden llevar al paciente en segundos a un cuadro de obstrucción severa por laringoespasmo o broncoespamo y dificultad en el manejo de la VAD (2).
El estridor persistente amerita la indicación del estudio de la VA. Se define como un sonido respiratorio de tono variable producido por el paso de un flujo turbulento de aire en zonas de VA con un calibre disminuido. Puede en reposo y apreciarse con el llanto o el ejercicio. Puede ser agudo o crónico, congénito o adquirido. Dependiendo de la fase del ciclo respiratorio en la que es audible puede orientar hacia el nivel de obstrucción: si es inspiratorio orienta hacia a un problema supraglótico, mientras que el espiratorio es característico de la VA intratorácica. Si el estridor es bifásico (inspiratorio-espiratorio) debemos pensar en patología glótica, subglótica o de tráquea extratorácica (5). Otro es la localización del tiroides lingual que es un resultado del fracaso en el descenso de la glándula tiroides desde la base de la lengua a través del conducto tiroglososo. También el quiste del conducto tirogloso se puede llenar con moco o líquido y si este situado en la base de la lengua puede causar obstrucción y estridor (5).
La causa más frecuente de estridor en la edad pediátrica es la laringomalacia, pues es la anomalía más frecuente de la VA Superior y es de tipo inspiratorio. No se conocen las causas exactas, pero inicia en las primeas semanas de vida y se cree puede deberse a un retraso en la maduración neuromuscular de las estructuras de soporte de la laringe que ocasiona colapso de las estructuras supraglóticas en la inspiración. La mayoría de los niños presentan sintomatología leve con un curso benigno y autolimitado con resolución de este al primer año de vida (es bueno tenerlo en cuenta en una cirugía electiva den el primer año de vida). Existe un 5 al 10 % con comportamiento grave, condicionando dificultad para la alimentación con presencia de cianosis, apnea e incluso puede conducir al desarrollo de hipertensión pulmonar y cor pulmonale. En estos pacientes es recomendable un estudio completo de la VA ya que está descrita la coexistencia de anomalías en la VA inferior en un 17 al 68 % (8).
El estridor bifásico que inicia con antecedentes de IOT se debe pensar en estenosis subglótica. Las de tipo congénito suelen ser simétricas, mientras las adquiridas son asimétricas. La Clínica será variable en función al grado de estenosis. El tratamiento puede ser conservador en formas leves, en casos moderados o graves puede ser preciso tratamiento endoscópico o quirúrgico (5).
Es importante señalar las diferentes causas de estridor según la fase respiratoria en la que este es audible y el origen anatómico del mismo como se refiere en la siguiente tabla 2 (8).
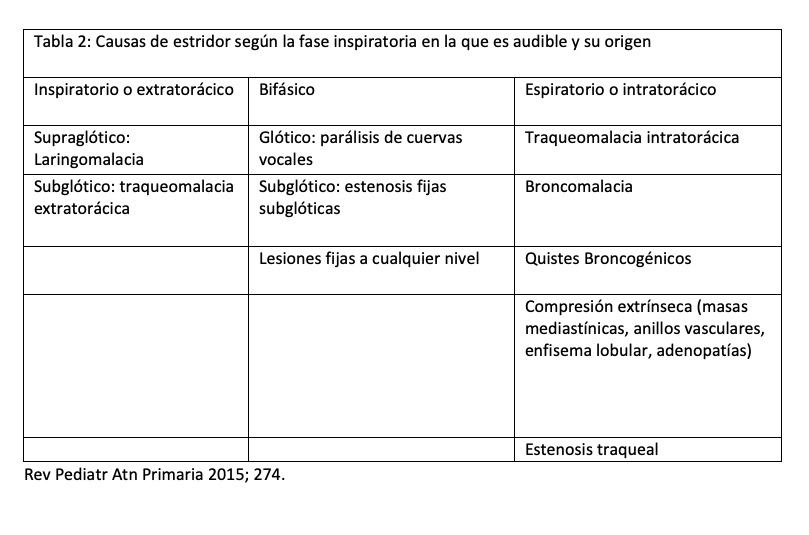
El ERGE Crónico no diagnosticado causa daño constante por el reflujo repetitivo al epitelio estriado de la mucosa respiratoria haciéndola más reactiva a periodos prolongados de inflamación crónica con disminución de la luz de la VA a nivel subglótico (9,10).
En ocasiones el asma refractaria al tratamiento puede ser por la presencia de ERGE, sin embargo, el reflujo puede ser tanto causa como consecuencia de la patología respiratoria, por lo que lo ideal es que la pH metría pueda demostrar una relación temporal entre los episodios de reflujo y la aparición de las sibilancias. En los casos en que esto no sea posible puede ser útil detectar un patrón de ERGE consistente en episodios prolongado durante el periodo nocturno (tos nocturna). Otro síntoma respiratorio de ERGE oculto es la tos crónica, neumonía recurrente, aspiraciones pulmonares, es imprescindible buscar la presencia de reflujos largos durante el sueño. Puede ser también la causa diversa de síntomas rinofaríngeos como laringitis, rinitis, sinusitis refractarias, otitis media, disfonía (9).
El constante reflujo provoca el crecimiento del tejido linfoide de anillo de Waldeyer (adenoides, amígdala lingual, amígdalas palatinas y tejido linfático faríngeo posterior) causar obstrucción de la luz orofaríngeo, esta condición puede ocasionar la indicación de Adeno-amigalectomía correctiva (Tonsilectomía) y estar expuestos a una VAD durante la IOT por estenosis subglótica no anticipada por causalidad de ERGE Crónico no tratado.
El monitoreo del pH esofágico de 24 horas ha sido el método diagnóstico de ERGE más confiable por muchos años. Recientemente el estudio de impedancia intraluminal multicanal (IIM) permite evaluar el tránsito esofágico e identificar anomalías esofágicas funcionales en trastorno motores esofágicos, se ha demostrado que el ERGE induce síntomas respiratorios en un 95 % por cambios en la inflamación crónica de la laringe (10)
La parálisis de cuerdas vocales es la segunda causa más importante de estridor infantil crónico. Puede ser congénita o adquirida. La parálisis congénita se manifiesta dentro del primer mes de vida. La parálisis bilateral produce estridor, cianosis y apnea. La parálisis unilateral se presenta disfonía. Las causas de parálisis unilateral y bilateral incluyen enfermedad neurológica (18 %), mielomeningocele con malformación de Arnold-Chiari e hidrocefalia (14 %), trauma al nacimiento (19 %), otras (15), Enfermedad maligna y/o familiar (1 %). En un 36 % de la enfermedad congénita no se identifica la causa, pero puede existir una asociación con otras enfermedades congénitas a nivel pulmonar, cardiovascular o esofágica. La parálisis adquirida de cuerdas vocales puede ser debido a trauma quirúrgico como es el ejemplo de la reparación de una fístula traqueoesofágica o defectos cardiacos. Cuando se confirma el diagnóstico de parálisis vocal se recomienda la evaluación cardiológica y neurológica. La traqueostomía está indicada en la parálisis bilateral (8).
Es importante tener en mente el gran número de alteraciones en el desarrollo que afecta a la región bucal y maxilofacial. La Gran mayoría de estas alteraciones han sido catalogadas como síndromes de orden genético, sin embargo, no todas pueden describirse como tales, pues existen anomalías del desarrollo que aparecen como consecuencia de una deficiente embriogénesis de la región facial provocando alteraciones anatómicas y funcionales, alejados de los componentes genéticos y cromosómicos específicos (11). Por lo que es considerable de buena práctica el realizar una exploración física detallada para identificar dimorfismos craneofaciales que alteran la permeabilidad y aseguramiento de la VA normal y difícil en la edad pediátrica.
Durante la exploración física se debe hacer búsqueda de malformaciones de cabeza, cuello y columna cervical. La forma y tamaño de la cabeza (Macrocefalia, Microcefalia), anomalías presentes en la cara como dimorfismos craneofaciales en donde existen cambios en el tamaño y simetría de sus componentes como lo son la distancias de orbitas oculares (hipertelorismo con puente nasal ancho y aplanado); nariz (permeabilidad de narinas), mandíbula y su movilidad (micrognatia su abordaje para permeabilizar la VA es con Intubación retromolar la mayoría de las veces), prominencia dentaria, tamaño (macroglosia como él Síndrome de Down, Síndrome de Beckwith-Wiedemann), forma de la lengua y del paladar (Paladar Hendido), labios (Labio leporino), implantación de orejas (Síndrome de Turner que se asocia a cuello grueso y circunferencia cervical grande), la forma de las orejas (microtia). Todos estos cambios son predictores clínicos de VAD. En un estudio se demostró que la microtía bilateral se asocia en un 42 % a la VAD y un 2 % la microtía unilateral. La presencia de hipoplasia mandibular acompañada de microtía bilateral es asociada a VAD en un 50 % ya que estas variables que afectan la apertura bucal, la ventilación con mascarilla facial, la laringoscopía directa, aplicación de dispositivos supraglóticos de rescate y la visualización de glotis (7).
Las anomalías anatómicas a nivel de la cabeza, facial, articulación temporomandibular, boca y lengua, nasales, palatinas, faríngeas, laríngeas, tráquea, bronquios, cuello y columna cervical.
A nivel de la cabeza puede presentarse lesiones tumorales y grandes crecimientos de la cabeza pueden interferir con la ventilación con máscara facial y/o laringoscopía e intubación. Entre las anomalías tumorales deben mencionarse a él encefalocele, Síndrome de Klippel-Feil (Sinostosis de vértebras cervicales), hidrocefalia (para permeabilizar la VA por laringoscopía directa se debe posicionar la cabeza en posición lateral), fisura palatina, sarcoma de tejidos blandos, macro y microcefalia, Síndrome de Hurler (es el más grave de los mucopolisacaridosis existiendo retraso en el desarrollo y crecimiento físico, tamaño de lengua grande, cara y puente nasal planos, frente prominente).
A nivel facial se describe el Síndrome de Apert, Enfermedad de Crouzon, Pierre-Robin, Síndrome de Treacher Collins, Síndrome de Freeman Sheldon, Síndrome de Pfeiffer. En estos pacientes puede estar afectada tanto la VA superior como la inferior; algunos presentan atresia de coanas, disminución del espacio nasofaríngeo, paladar hendido y deformado. Estas estructuras causan compromiso ventilatorio y apnea obstructiva que aumenta a medida que el niño crece (excepto en la secuencia del síndrome de Pierre-Robin que mejora con la edad). (Tabla 3) (11).
A Nivel de la articulación temporomandibular se puede presentar una disminución de la movilidad o una anquilosis, ya sea congénita, traumática, inflamatoria o infecciosa. Presencia de hiperplasia -hipoplasia mandibular como la micrognatia como el Síndrome Goldenhar (tiene anomalías auditivas, auriculares, hipoplasia mandibular y anomalía vertebral), Pierre-Robin, Turner, Treacher Collins, Morquio (Es una mucopolisacaridosis tipo IV-A, enfermedad de tipo lisosomal que presenta deformidad ósea, hidrocefalia, cuello flexionado, xifosis, giba lumbar, pectus carinatum debido a la hipoplasia vertebral y diafisaria de la cabeza femoral, cúbito, radio así como laxitud articular) (4).
A nivel de boca y lengua se presenta la microstomías (apertura bucal pequeña como en el síndrome de cara plana o aplanada que presenta esta variable además de orejas grandes e implantación baja, voz hipernasal); Quemaduras, hemangiomas de lengua, tumores, macroglosia como en el Síndrome de Down y Hurler, presencia de angina de Ludwing, edema secundario a cirugía, macroglositis por manipulación y hematoma lingual.
A Nivel de las fosas nasales, palatinas y faríngeas puede existir atresia de coanas, presencia de cuerpos extraños, encefalocele, paladar hendido, edema palatino, presencia de hematomas, hipertrofia amigdalina y adenoides entre los 4 y 6 años de edad se observa el mayor crecimiento d estos (causa obstrucción), tumores, absceso retrofaríngeo, procesos inflamatorios (Epidermolisis Bullosa que presenta alrededor de la boca una piel frágil con ámpulas en respuesta a una lesión menor, calor, rozamiento, fricción leve, uso de cinta para fijación).
A nivel laríngea puede existir la laringomalacia es la falta de desarrollo incompleto de las estructuras rígidas de la laringe como resultado existe una debilidad y agrandamiento de las estructuras blandas lo cual provoca un colapso de las estructuras blandas durante la respiración causando estridor laríngeo (lo cual mejora con él tiempo, es más audible durante la fase de sueño, alimentación y se aumenta en los procesos infecciosos), se relaciona al ERGE por lo que es importante dar tratamiento conservador para el reflujo gastro-esofágico; La corrección del padecimiento mediante un procedimiento quirúrgico conlleva el ver la laringe y cortar el exceso de tejidos blandos como son los pliegues Ari- epiglóticos para hacer más espacio para que pase el aire a través de la tráquea.
Otras anomalías son la epiglotitis (signos de alarma es el babeo continuo, posición en trípode y cianosis); parálisis de cuerda vocal, bridas laríngeas, papilomatosis, cuerpo extraño, estenosis subglóticas, infecciones como el Croup laríngeo, estenosis traumática y edema (3).
En la tráquea y bronquios puede presentarse la traqueomalacia congénita es poco común y es debido a que el cartílago de la tráquea no se ha desarrollado en forma apropiada. Las paredes de la tráquea son flácidas en lugar de rígidas, con estrechez de los anillos traqueales durante la inhalación provocando un paso de flujo de aire turbulento caracterizado por una respiración chillona, ruidosa y vibratoria, se agudiza con la alimentación y procesos inflamatorios-infecciosos, se asocia a ERGE.
Otros padecimientos a este nivel son de tipo infecciosas, traqueítis, masa mediastínica, malformaciones vasculares, aspiración de cuerpo extraño, edema, estenosis traqueal adquirida, fístulas, divertículos y bridas (3).
En el cuello y columna cervical puede existir tumores como los linfagiomas gigantes, hemangiomas, teratomas, bridas cicatriciales, inflamación, columna rígida como el Síndrome de Klippel-Feil, cirugía previa, fractura vertebral (3). Se describe en la siguiente tabla (Tabla 3) las patologías de afección genética y/o congénita que alteran la morfología anatómica, clínica y la funcionalidad de la VA, en ella se describen las estrategias de abordaje para la planeación de rescate y anticipada de la VA referencia.
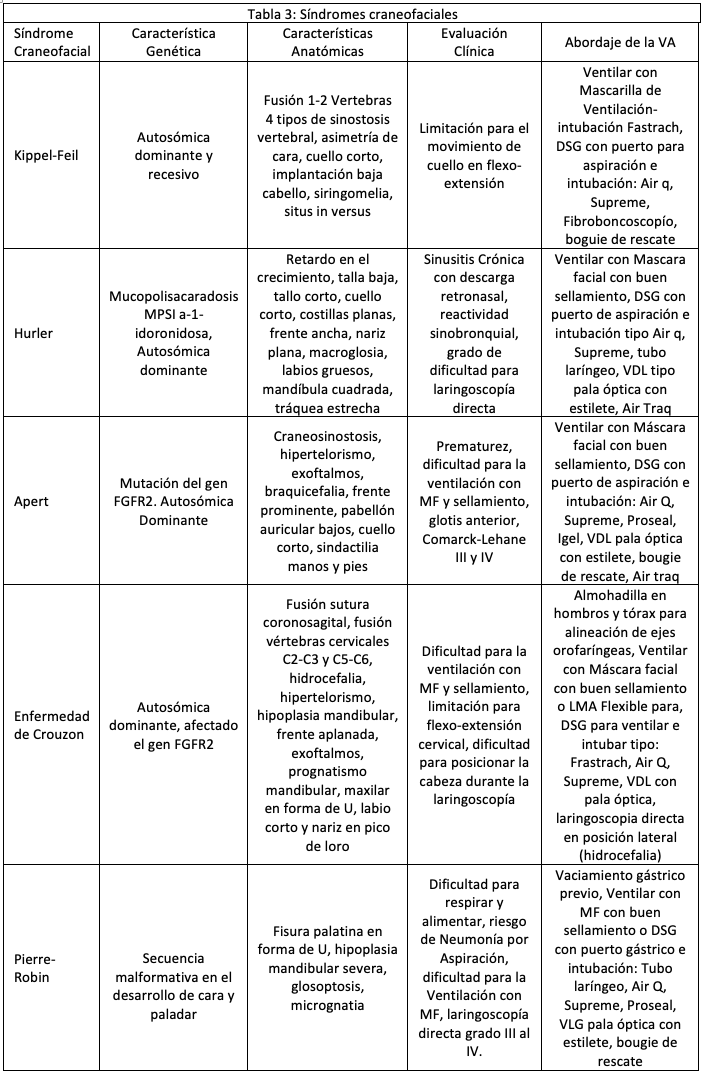
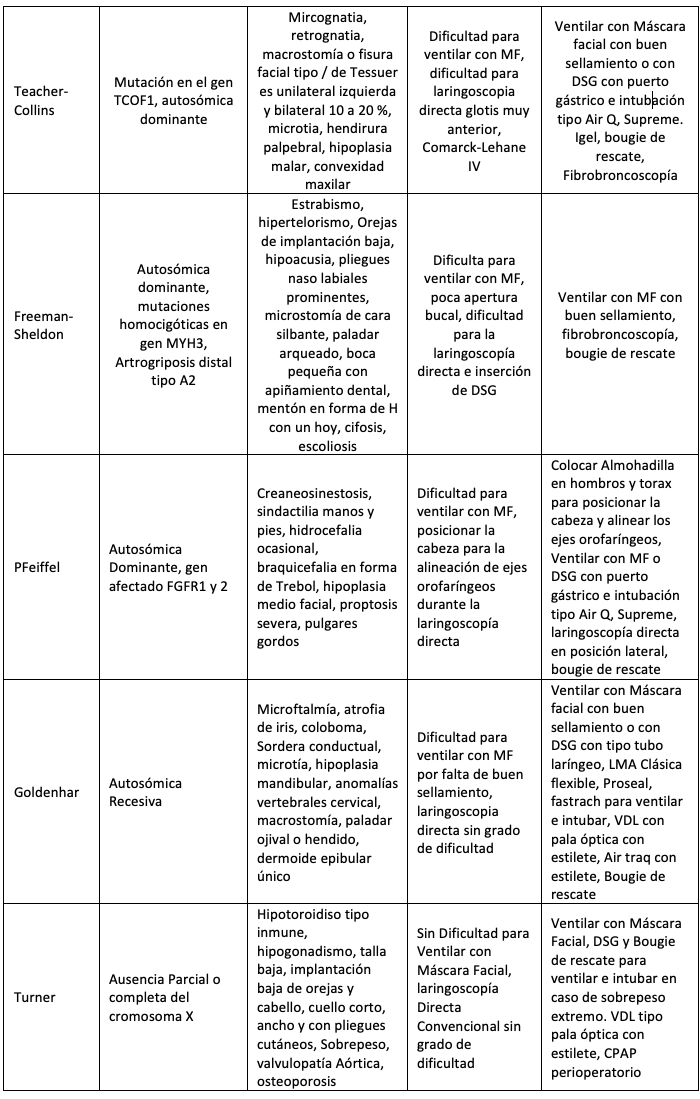
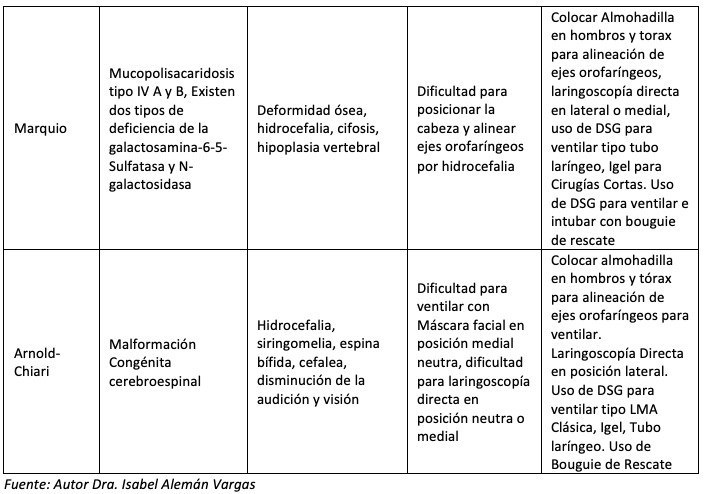
A pesar de lo expuesto es importante recordar que no existe ningún factor anatómico que de forma individual pueda predecir la posibilidad de encontrar dificultades para la intubación traqueal. El valor predictivo de las pruebas o test de pre-intubación en los niños es bajo comparado con el paciente adultos. (4). Hasta el momento no se cuenta con una escala única y específica para evaluar la VA pediátrica, que contenga en contexto todas las variables. En la siguiente (Tabla 3) que conjuntas una serie de variables útiles para estratificar la VA pediátrica y una mejor planeación de la VA normal y VAD anticipada con el propósito de identificar los niños con mayor riesgo y las estrategias más seguras para su manejo de la VA.
La VAD tiene diferencia incidencia según la capacitación del personal evaluado, puede ser tan baja entre anestesiólogos considerados expertos en un 0.05 % o tan alta en atención prehospitalaria en un 11 % entre estos límites se ubica la incidencia de VAD pediátrica en médicos generales, pediatrías e intensivistas. Entre más pequeño es él niño mayor será la posibilidad de tener una VAD. El fallo en el manejo de la VAD pediátrica es de atención inmediata pues fase de hipoxemia se presenta en menor tiempo respondiendo a este estado con bradicardia y parada cardiaca, lesión cerebral o muerte (4).
Durante la preparación de la VA se debe tomar el tiempo para evaluar y clasificar la VA, considerando el entorno en el cual se va a abordar, definir el estado físico del niño, su clase funcional, el riesgo quirúrgico y la urgencia del procedimiento (2).
Son escasos los estudios de la VA realizados en urgencias y en especial los que analizan factores predictores de dificultad. La mayoría de ellos se han hecho en salas de anestesiología, otros en unidades de cuidados intensivo y algunas de ellos en escenarios de simulación. La población más afectada en morbilidad y mortalidad por manejo inadecuado de la VA, es el recién nacido y lactantes menores (menores de 1 año). Dentro de la morbilidad puede ocurrir ventilación inadecuada, apenas y obstrucción bronquial. La mayor parte de estas complicaciones son evitables y al analizarse se detectan los siguientes problemas como es el fallo de reconocer y anticiparse a la VAD, revisión inadecuada del equipo y monitoreo, escasa vigilancia, preparación insuficiente frete a situaciones adversas detectadas y la falta de habilidades técnica, especialmente en situaciones de estrés (6).
Las complicaciones se presentan en un 43 % en los niños y en un 30 % en el adulto. Por ello evaluar preoperatoriamente las diferentes causas que puede llevar a una intubación difícil, es de vital importancia para prevenir las complicaciones (7).
La siguiente escala de evaluación de la VA pediátrica estaba basada en las variables anatómicas, entidades clínicas y congénitas más frecuentes que alteran la morfología y funcionamiento de la VA en la edad pediátrica, representa un contexto práctico para evaluar, estratificar y evaluar cada escenario clínico de VA normal y difícil. A continuación, se describe la siguiente propuesta que es el objetivo de este presente artículo, el compartir la “Escala para evaluar la VA en Pediatría” (EVAP) como se muestra en la (Tabla 4). Para la puntuación de esta escala “EVAP” cada variable equivale a un punto y se estratifican en tres grados de complejidad según los puntos obtenidos por sumatoria (Tabla V). Es importante que se tenga el hábito de observar y medir las estructuras anatómicas (boca, cuello, nariz, labios) de la vía aérea superior, así como los ejes y líneas de los puntos cráneo-faciales (mandíbula, implante auricular, simetría ocular, puente nasal, forma del paladar, trago, malar).
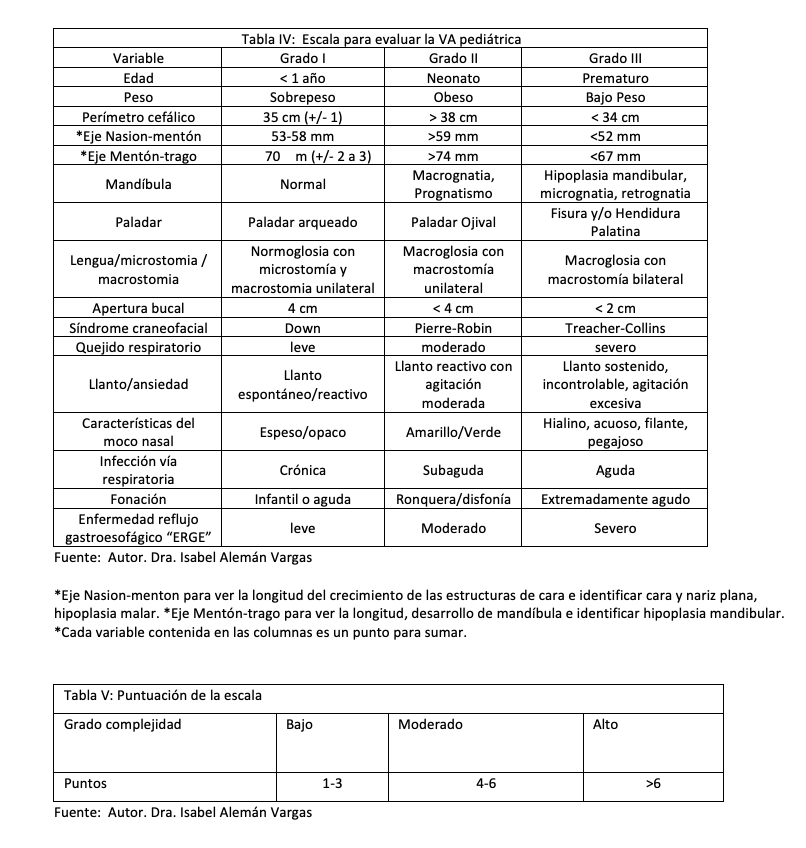
Asumir que la práctica diaria da la pericia y el entrenamiento suficiente para escenarios de crisis es un error. Por lo que es importante prepararse con talleres de simulación en escenarios críticos con maniquíes con alta fidelidad de variables anatómicas y fisiológicas de la vía respiratoria.
Es importante talleres de simulación en conjunto con el equipo quirúrgico de trabajo, utilizando los recursos propios para familiarizarse con su funcionamiento elaborando algoritmos de manejo locales o microambiente hospitalario para enfrentar el estado emergente de la vía área.
La limitante y desventaja de la presente escala es la necesidad de validar dicha propuesta. Se requiere de hacer un estudio multicéntrico bien diseñado, para obtener resultados comparables con otras escalas. Se requiere de un instrumento de validez en donde destaque la fiabilidad, la cual hace referencia al hecho de medir una variable de manera constante y la validez, como aquel instrumento que mida lo que quiere medir.
La finalidad de esta nueva escala, es dar un panorama más contextualizado y practico mediante un puntaje de evaluación que establece grado de riesgo y estratificación para anticiparnos al manejo adecuado de la VAD pediátrica.
Referencias:
2. Rivera-Tocancipá D, Díaz-Sánchez E. “Como ventilar al niño anestesiado en las máquinas de Anestesia Modernas”. Rev. Colomb Anestesiol 2018; 46 (Supl1): 52-57. http://dx.doi.org/10.1097/CJ9 0000000000000046
3. Haydee Osses C.” Vía aérea difícil en Pediatría”. Rev. Chil Aneste. 2010;39(2): 125.132
4. Álvarez JM, Valerón Lemaur. “Vía aérea difícil en pediatría. definición, etiología, clasificación y valoración”. SECIP (Sociedad y fundación Española de Cuidados Intensivos Pediátricos). 2016;1-17. www.enfermeriaaps.com/portal/doenload/cuidadosintensivosPediatricos
5. Goméz-Sáez F, Navazo-Eguía AI. Exploración de la vía aérea en el paciente pediátrico”. Rev. ORL. 2018; 9(Supl1): 49-61
6. Figueroa-Uribe F, Flores del Razo. “Escalas predictoras para identificar vía aérea difícil en población pediátrica: su utilidad en el servicio de urgencias”. Rev. Mex Pediatr. 2019; 86(4): 162-164
7. Pérez-Lara JA. Acosta Menoya. “Vía aérea difícil en pediatría: signos predictores”. Rev Ciencias Médicas. 2007; 11(1): 1-12
8. Camin-Cabrera CF, Sánchez-Perales. “Causas de Estridor en laringomalacia: dos formas de presentación poco habituales”. Rev. Pediatr Aten Primaria. 2019; 17(68): 271-278
9. Carabaño-Aguado I, Armas-Ramos A, Ortigosa del Castillo. Reflujo gastroesofágico y esofagitis en niños”. Editor Ergon “Sociedad de Gastroenterología, Hepatología y Nutrición Pediátrica”. Edición 5ta. España. Editorial Lit. 2021, pp 19-32. España. ISB 9788417844998
10. Heller Rouassant S. “ERGE en Pediatría”. Rev. Gastroenterol Mex. 2016; 81(Spp1): 71-73
11. Tiol-Carrillo A. Secuencia malformativa de Pierre-Robin”. Rev. ADM. 201; 74(3): 146-15
12. Guapi Nauñay IA, Martínez-Carvajal. “Síndrome Klipper-Feil un caso Clínico”. Rev Chil Pediatr. 2019; 90(2): 194-201
13. Cadena-López IM, Rodríguez-Bonito R. Síndrome de Goldenhar”. Arch Inv Mat Inf. 2014; VI(3): 138-142
14. Chaib Saavedra SO, Delgadillo-Navarro SA. Síndrome de Cruzon. Rev Medica MD. 2018; 10(1): 60-63}
15. López-Siguero JP. Síndrome de Turner. Rev Esp Endocinol Pediatr. 2020; 11Supp1): 48-53
16. Pacheco YDC. Lorca-García. B. Berenguer. “Macrostomía bilateral aislada”. Rev Cir Pediatr. 2016; 29(1): 41-44
17. Cammarata-Scalisi FA, Avendaño F, Síndrome Beckwith-Widemann”. Arch Argen Pediatr 2018; 116(5): 368-373
