Anestesia en México 2024; Volumen 36: Número 2
Menú
Trabajos originales
1. Cumplimiento de los Estándares de la NOM-006-SSA3-2011 Para el Ejercicio de la nestesiología en el Llenado de la Hoja de Registro de Anestesia y Recuperación Para Procedimientos Ambulatorios.
Janaí Santiago-López, Víctor León-Ramírez, Isaac Raziel Oliva-Hernández.
2. Delirium Postanestésico Asociado a Anestesia Regional en Cirugía de Cadera en Población Geriátrica.
Favela-Torres KP, Mendoza-Gastélum MAC.
3. Adicción a las Redes Sociales de los Médicos Residentes de Anestesiología en un Hospital de Tercer Nivel.
Daniel Roberto Castillo-García, Oscar Eduardo García-Sagundo, Víctor León- Ramírez, María del Rocío Courdurier-Ortega, Janaí Santiago-López.
Artículos de Revisión
1. Trastorno de Uso de Sustancias (tus) En los Anestesiólogos.
Bernardette Casillas-Sánchez
2. Lo Que Hay que Conocer de Aspectos Ecográficos en la Vía Aérea.
Guadarrama-Quijada Francisco.
Casos clínicos
1. Vía Aérea Difícil No Anticipada en Cirugía Electiva, Paciente Ventilable no Intubable:
Planeación de Estrategias y Revisión de la Literatura.
Anchondo A, Acosta R, Acevedo M,
Ruiz C, Méndez A.
2. Bloqueo infraclavicular para Amputación de Mano en Lactante Cardiópata: Reporte de Caso.
Enrique Uribe-Carrete, Liliana Cecilia González-González, Brenda Moreno-Apodaca, Luis Carlos Aguilera-Savage.
3. Enfermedad de Pompe: Implicaciones del Manejo Anestésico.
Reporte de Caso. Vallejos Mita Gloria Martha, Loredo-García Nancy Guadalupe. Peña-Olvera Silvia.
4. Eritropoyetina, una Alternativa de Tratamiento en los Pacientes Testigos de Jehová.
Luna González Arístides de Jesús.
5. Diagnóstico y Tratamiento de Sobrecarga Hídrica en el Posoperatorio Inmediato, en un
Paciente Neuroquirúrgico.
Wilson-Manríquez Eduardo Antonio, Nieto-Rizo, Javier Nieto.
6. Manejo de la Vía Aérea en Neonato con Linfagioma Gigante:
Reporte de Caso. Hernández López Jeaninne, Cortés- Julián Leticia, Dosta-Herrera Juan José.
7. Midriasis Arreactiva Persistente Por Uso de Bloqueadores Neuromusculares:
Reporte de Caso. Alondra Velázquez-Pillado, Kenia Olvera-Guerrero, Aviña-Pérez Diego.
8. Manejo Anestésico del Síndrome de Susac.
Mariana Paz-Rossainz, J Ramón-Flores, Enrique Hernández-Cortéz, Miguel-Magaña, Yolanda Martina Martínez-Barragán.
9. Síndrome de Jacobsen Reporte de Caso: Descifrando la Incógnita en el Manejo Anestésico.
Loredo-García Nancy Guadalupe, Martínez-Martínez Julio Leonardo, Jiménez-Hernández
María Guadalupe, Mancera-Elías Gabriel.
10. Fístula Cutánea de LCR Secundario a Catéter Epidural en Paciente Pediátrico: Reporte de
Caso.
María de Jesús Cortés-Cervantes, Yadira Kiawhtzin Orea-Villa, Paola Berenice Santana-Guerrero, Carlos Armando Sánchez-Navarro.
11.
Gastrosquisis: Manejo que Todo Anestesiólogo Debe Conocer.
Loredo-García Nancy Guadalupe, González-Flores María de Lourdes, Pérez-Hernández Alejandro
Compliance with the Standards of NOM-006-SSA3-2011 for the Practice of Anesthesiology Regarding the Filling of the Anesthesia and Recovery Record Sheet for Outpatient Procedures.
3Isaac Raziel Oliva-Hernández. Departamento de Anestesiología del Hospital de Especialidades “Dr. Bernardo Sepúlveda Gutiérrez” del Centro Médico Nacional “Siglo XXI” del Instituto Mexicano del Seguro Social. Ciudad de México.
Anestesia en México 2024; 36(2):
Fecha de recepción febrero 2024, fecha de revisión abril 2024, fecha de publicación mayo 2024
janai_santiago@yahoo.com.mx
La evaluación de los servicios en cuidados médicos en anestesia se realiza a través del llenado de la hoja de registro de anestesia y recuperación, en concordancia con la NOM 006-SSA3-2011, por su impacto en el
y recuperación, para procedimientos ambulatorios en nuestra unidad hospitalaria. Material y métodos: Se realizo un estudio transversal descriptivo en el que incluyo 180 pacientes de la institución obtenidos mediante muestreo aleatorio simple, que fueron sometidos a cirugía electiva ambulatoria. Se evaluó el cumplimiento de los estándares establecidos en el llenado de la hoja de registro de anestesia y recuperación, en concordancia con la NOM-006-SSA3-2011. Para el análisis de variables, se realizó estadística descriptiva, utilizando, frecuencias simples y proporciones. La información se proceso con SPSS v-26.0. Resultados: El porcentaje de cumplimiento global en el llenado fue 89.30 %. El menor porcentaje lo tuvo la sección del “registro transanestésico” con 83.39 % y de estos solo 52.22 % estaban escritos con letra legible en lenguaje técnico médico. Conclusión: El porcentaje de cumplimiento global, del llenado de la hoja de registro de anestesia y recuperación, para procedimientos ambulatorios en nuestra unidad hospitalaria esta acorde a los estándares establecidos a nivel institucional. Palabras clave: Calidad; Anestesia; Cirugía ambulatoria.
Abstract
Introduction: The evaluation of medical care services related to anesthesia is based on the anesthesia and recovery record sheet, which must be filled in accordance with NOM 006-SSA3-2011. This document influences the follow-up and evolution of the patient and helps ensure compliance with the ethical and legal issues associated with anesthetic practice. Objective: Determine the percentage of compliance with filling each of the sections in the anesthesia and recovery record sheet for outpatient procedures in our hospital unit. Material and methods: A descriptive cross-sectional study involving 180 randomly selected patients from the institution who underwent elective outpatient surgery. Compliance with the standards for filling the anesthesia and recovery record sheet in accordance with NOM-006-SSA3-2011 was evaluated. The variables were analyzed with descriptive statistics, using measures of simple frequencies and proportions. The data were processed with SPSS v-26.0. Results: The overall percentage of compliance with filling the record sheet was 89.30%. The section “ transanesthetic record “ had the lowest percentage with 83.39%, and of these only 52.22% were written legibly in medical technical language.
El ejercicio de la anestesiología es por sí mismo una práctica de alto riesgo, lo que hace imperativo implementar guías y estándares que orienten al personal a seguir protocolos establecidos con el objetivo de reducir los índices de morbilidad y mortalidad (1).
La práctica anestésica es altamente estresante y de alto riesgo, esto puede llevar a alguna omisión en cuanto a los protocolos de manejo de los pacientes, generando desviaciones en los procesos de atención lo que aumenta la probabilidad de errores (2).
Debido a que se han identificado en los últimos años los factores de riesgo en los pacientes sometidos a anestesia, se ha determinado la necesidad de un monitor básico al momento del acto anestésico.
La vigilancia y registro de los signos vitales durante el manejo anestésico es esencial. Afecta directamente el resultado de la misma, lo cual sugiere que esta vigilancia de los parámetros cardiorrespiratorios disminuye la incidencia de accidentes graves (1).
Es por eso que las directrices emitidas por los centros y servicios de cuidados médicos (CMS), requieren que los anestesiólogos documenten siete elementos del cuidado anestésico: realizar un examen y evaluación pre anestésica, prescribir un plan anestésico, participar personalmente en los procedimientos más exigentes del plan anestésico, incluyendo la inducción y la emergencia, garantizar que cualquier procedimiento en el plan anestésico otorgado sea brindado por un individuo calificado, monitorear el curso de la administración anestésica a intervalos frecuentes, permanecer físicamente presente y estar disponible para diagnóstico y tratamiento de emergencias y proporcionar cuidado postanestésico (3,4).
Es relevante que, en cuestión de cumplimiento normativo, haya un apego a los lineamientos preanestésicos, transanestésicos y postanestésicos, en este sentido, en 1998 la Secretaría de Salud emitió la Norma Oficial referente al expediente clínico y es en marzo del 2012 que se actualiza la norma oficial para el ejercicio de la
anestesiología (NOM 006-SSA3-2011). A pesar de que esta norma estipula que todos los anestesiólogos deben integrar en forma completa el expediente clínico, existe falta de apego a estos lineamientos sobre todo por parte de servicios como cirugía y anestesia. Por razones desconocidas son muchos los anestesiólogos que no registran en forma adecuada y legible su actividad profesional en el expediente (5-15).
Empero, es frecuente que cuando se analizan los expedientes, se encuentren los registros de anestesia y recuperación llenados en forma inapropiada. Este factor de grafofobia puede ser un elemento de controversia en el momento de elaborar peritajes. Como se menciona en las recomendaciones de la ASA: Es un beneficio muy pobre el haber dado una muy buena anestesia, si es imposible decir qué se hizo y cuándo se hizo (5).
El registro clínico perioperatorio, proveniente de la monitorización continua y las interacciones entre los miembros de equipo quirúrgico son de suma importancia legal y ética (6).
El anestesiólogo es quien realiza el llenado del documento, donde se debe incluir una evaluación completa del paciente, así como la información técnica sobre el equipamiento y los dispositivos utilizados durante el procedimiento, además se incluye datos detallados de la técnica anestésica, la hidroterapia y la medicación, además de las complicaciones, eventos adversos y todo lo referente al proceso de recuperación (7-9).
Los registros clínicos perioperatorios son testimonio documental sobre actos y conductas profesionales donde queda recogida toda la información sobre la actividad anestésica referente al paciente durante el acto quirúrgico. Es necesario un adecuado registro de la evolución de las condiciones y de las diferentes intervenciones realizadas, las cuales pueden repercutir tanto en el seguimiento y evolución final del paciente como en el reforzamiento de las cuestiones éticas y legales que suponen cada una de las acciones de los anestesiólogos (8-15).
En el caso de las Normas Oficiales Mexicanas (NOM) en materia sanitaria, se busca mejorar los procesos para obtener buenos resultados y otorgar la atención y servicios médicos de calidad que los pacientes exigen a través de la mejora continua, con la participación de todos y cada uno de los integrantes del equipo de salud.
En este sentido, la evaluación de la hoja de registro
de anestesia y recuperación es utilizada como una herramienta que es determinante en la calidad de atención anestésica, por lo que es una necesidad incuestionable promover su llenado adecuado.
Material y método
Con la aprobación de la Comité Local de Investigación en Salud (CLIS), y con el objeto de conocer el porcentaje de cumplimiento de cada uno de los indicadores del llenado de la hoja de registro de anestesia y recuperación (2430- 003-006) para procedimientos ambulatorios en la unidad hospitalaria. Se realizó un estudio transversal descriptivo, que incluyo a 180 pacientes, de cualquier edad y género, que fueron sometidos a cirugía electiva ambulatoria durante el periodo comprendido del 01 de enero al 30 de junio de 2021. Se excluyeron aquellos pacientes que al momento de la aleatorización contaron con números nones, o bien aquellos que al momento de la solicitud de los expedientes no se localizaron los mismos.
Para la obtención del listado de pacientes, se llevó a cabo una revisión del Sistema de Registro de la Oportunidad Quirúrgica (INDOQ). Se tomó el nombre y número de seguridad social de los pacientes sometidos a cirugía electiva ambulatoria durante el periodo de estudio, numerándose de forma consecutiva de acuerdo con la fecha y hora de realización del procedimiento, y de esta manera se confeccionó un listado inicial de pacientes. Posteriormente se procedió a aleatorizarlos.
Entonces se procedió a la solicitud de los expedientes en el departamento de archivo clínico aplicándose los criterios de no inclusión y de eliminación, seleccionando así la serie clínica definitiva. Una vez elaborado el listado, mediante la revisión del expediente clínico, se evaluó la hoja de registro de anestesia y recuperación (2430- 003-006) mediante una lista de cotejo. Los resultados obtenidos fueron recogidos en un formulario de fácil aplicación, con pruebas diseñadas para tal fin. El proceso de identificación de expedientes de pacientes fue realizado por el médico residente de Anestesiología. Los datos obtenidos fueron exportados a una base de datos electrónica para su procesamiento posterior.
Se realizó estadística descriptiva, utilizando medidas de tendencia central y dispersión. Las variables continuas se expresaron en promedio ± desviación estándar y las
variables categóricas en porcentaje. La información se procesó con el software SPSS para Mac (SPSS, inc. Chicago, IL, USA) versión 26.0. Los resultados se presentaron en tablas y gráficas.
Resultados
Se recopilaron datos de un total de 180 hojas de registro de anestesia y recuperación para procedimientos ambulatorios, de los cuales 50 % (90) correspondían al serviciodeurologíayelrestantealserviciodeoftalmología. Ninguna hoja de registro de anestesia y recuperación (2430-003-006) cumplió con todos los rubros de las cinco secciones, que la integran.
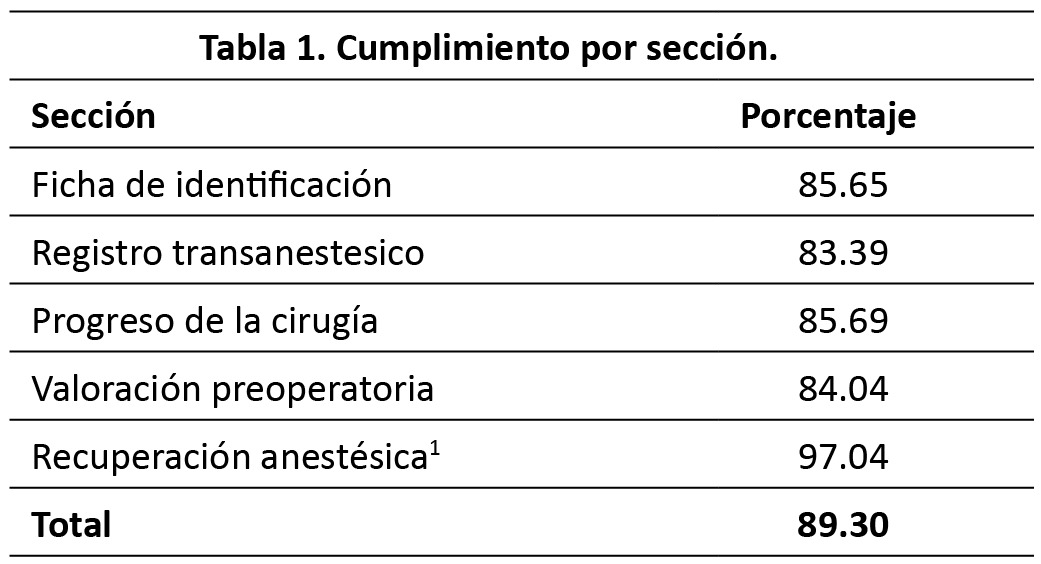
El porcentaje de cumplimiento global para procedimientos ambulatorios fue 89.30 %, en la (Tabla 1), se muestra con detalle el porcentaje de cumplimiento por sección de evaluación.
La sección de “recuperación anestésica” fue la que presentó un mayor porcentaje de cumplimiento. Mientras que el menor porcentaje lo tuvo la sección de “registro Transanestésico”.
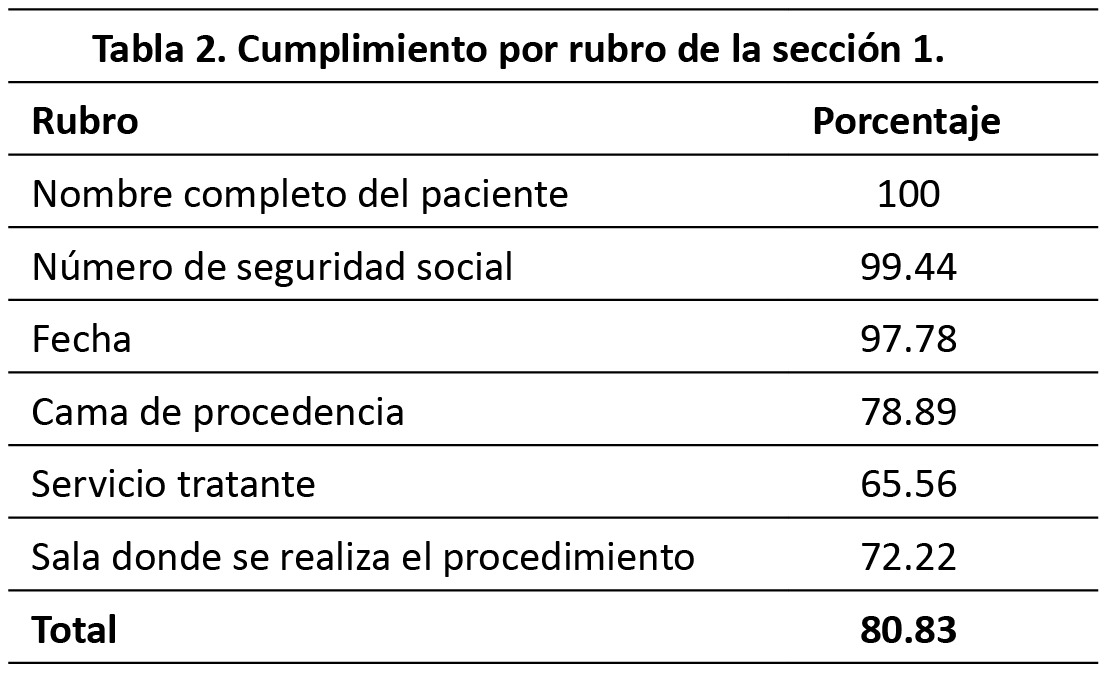
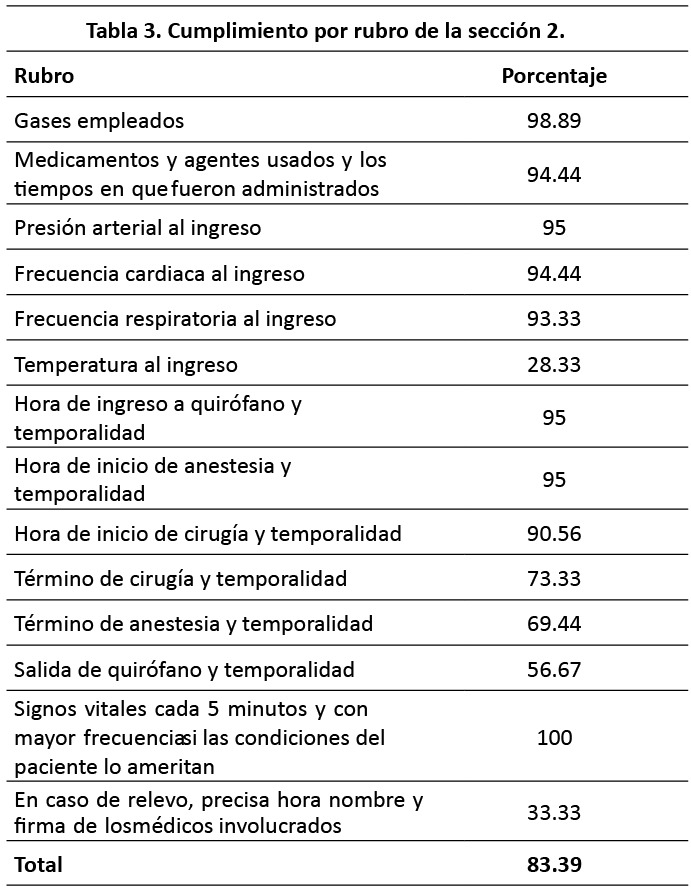
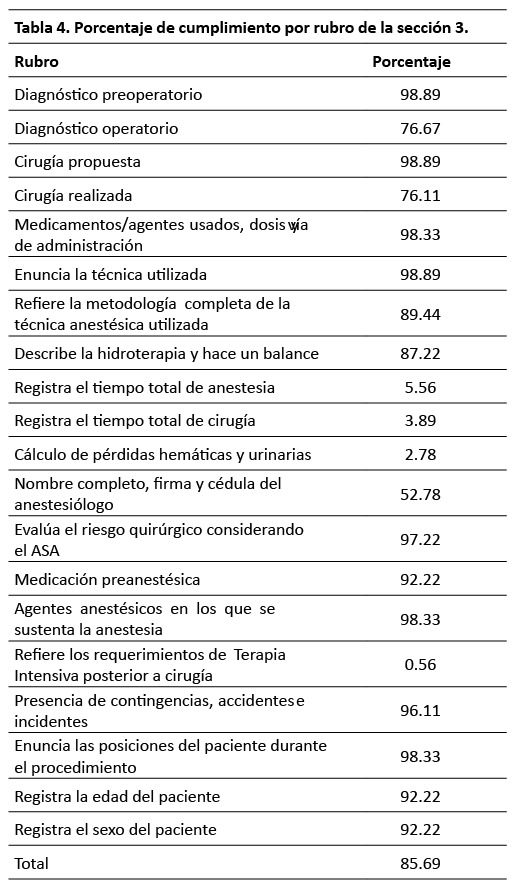
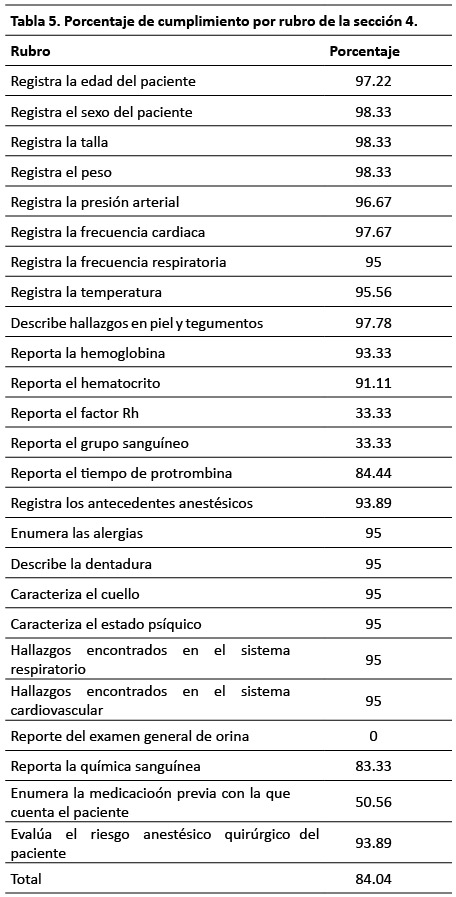
En el siguiente apartado se describen a detalle los resultados de cada una de las secciones de evaluación. S1: Ficha de identificación. El porcentaje de cumplimiento de esta sección fue 85.65 %. El 100 % de las hojas de registro de anestesia y recuperación contaban con el nombre completo del paciente,solo 65.56 % enunciaban el servicio quirúrgico tratante (Tabla 2). S2: Registro transanestesico. El porcentaje de cumplimiento de esta sección fue 83.39 %. El 100 % de las hojas de registro de anestesia y recuperación contaban con los signos vitales cada cinco minutos y con mayor frecuencia si las condiciones del paciente lo ameritan, solo 28.33 % enunciaban la temperatura al ingreso a quirófano (Tabla 3). S3: Progreso de la cirugía. El porcentaje de cumplimiento de esta sección fue 85.69%. El 98.89 % de las hojas de registro de anestesia y recuperación contaban con el diagnóstico preoperatorio, la cirugía propuesta y enuncia la técnica anestésica empleada, solo 0.56% hacen referencia sobre la necesidad del paciente de una Unidad de Terapia Intensiva posterior a la cirugía (Tabla 4). S4: Valoración preoperatoria. El porcentaje de cumplimiento de esta sección fue 84.04%. 98.33% de las hojas de registro de anestesia y recuperación enunciaban el sexo, la talla y el peso del paciente. En ninguno de los casos se registró el
Discusión
El requisito de documentación escrita se remonta al código civil napoleónico adoptado bajo Luis XIV de Francia en 1667. El primer registro anestésico, el famoso “cuadro de éter” fue elaborado por Cushing y Codman en 1894. Basado en su propia colección, Lundy enfatizó aún más la importancia de los registros de anestesia en 1924.15
La hoja de registro de anestesia y recuperación fue creada para auxiliar al médico anestesiólogo en su tarea de servir y sus funciones son claramente tres: la primera es ayudar a organizar las ideas que tiene el médico respecto a la situación del paciente en términos del manejo perioperatorio, y lo ayuda a organizarse al hacerlas explícitas; en segundo lugar, sirve para intercomunicarse entre distintos profesionales de la salud que atienden de manera concurrente al paciente; en tercer lugar y último, la hoja de registro se originó para darle continuidad y seguimiento al paciente, es decir, seguirlo potencialmente a lo largo de su procedimiento actual y de su vida y que los colegas y otros médicos sepan, conozcan los antecedentes, y eso les permite tomar mejores decisiones en cuanto a su manejo actual y futuros.
De igual manera, se considera la hoja de registro de
Es por eso, que resulta indispensable que en la hoja de registro de anestesia y recuperación se describan todas y cada una de las acciones médicas realizadas durante la atención proporcionada, de forma completa y ordenada.
De acuerdo con las especificaciones de la NOM, asumimos que los registros de anestesia y recuperación, se deberían encontrar correctamente estructurados y completos, sin embargo, no sucede así en el 10.7 % de los casos.
Es de resaltar que en este estudio se encontró, un bajo porcentaje de registros incompletos, en comparación con los hallazgos reportados por Curtis WB y colaboradores (15), que encontraron que 56.2 % de los registros de anestesia y recuperación estaban incompletos.
El tiempo y los recursos disponibles, pudieron ser variables intervinientes en el proceso y determinar el porcentaje de incumplimiento en el llenado de la hoja de registro de anestesia y recuperación, ya que al tratarse de procedimientos ambulatorios (de corta duración), pudieran limitar el tiempo para la realización de la documentación perioperatoria requerida. Evidenciamos un porcentaje de cumplimiento del 84.04 % en la valoración preoperatoria, siendo el segundo más bajo de nuestro análisis, lo que podría reflejar una desvinculación de los médicos anestesiólogos en su elaboración, siendo esta una de las secciones importantes en la atención del paciente, y que representa el insumo principal para el acceso al
servicio anestésico-quirúrgico.
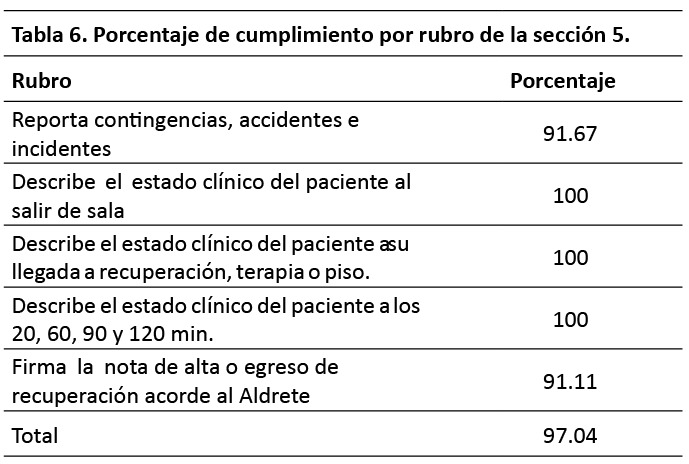
Se encontró un mayor porcentaje de cumplimiento en la recuperación de la anestesia en comparación con las secciones anteriores, refiriendo un nivel de cumplimiento de 97.04 %, obteniendo un mayor porcentaje en los rubros donde se describían el estado clínico del paciente al salir de sala, a su llegada a la sala de recuperación, a los 20, 60, 90 y 120 min de su estadía en la misma, a su llegada a la unidad de terapia intensiva o a piso, sin embargo, era de esperarse encontrar un mayor porcentaje en esta sección, ya que al tratarse de procedimientos ambulatorios el personal de enfermería requiere su completo llenado para avalar la nota de alta del servicio de anestesiología y enviar al paciente a su domicilio.
El presente estudio nos facultó para documentar que el porcentaje de cumplimiento del llenado de la hoja de registro de anestesia y recuperación, de acuerdo a la NOM- 006-SSA3-2011 para el ejercicio de la anestesiología, es adecuado, empero nos permitió identificar ventanas de oportunidad para el mejor cumplimiento en el llenado de la misma, aportándonos un elemento de juicio excelente, para prevenir y corregir aspectos significativos de la atención del paciente anestesiado, que redundarán en la calidad y la eficiencia del proceso anestésico-quirúrgico.
Conclusión
El porcentaje de cumplimiento global, del llenado de la hoja de registro de anestesia y recuperación, para procedimientos ambulatorios en nuestra unidad hospitalaria, está acorde a los estándares establecidos a nivel institucional.
Referencias
1. Higgins Guerra LF. Manejo del expediente clínico en anes- tesia. [Internet]. MEDITIPS. 2017 [citado 27 octubre 2021]. Disponible en: https://www.google.com/rl?sa=t&rct=- j&q=&esrc=s&source=web&cd=&cad=rja&uact=8&ve- d=2ahUKEwi3jcLAjaP4AhURDkQIHWo2CBwQFnoECAsQA- Q&url=https%3A%2F%2Fwww.meditips.com%2F2017%- 2F09%2F28%2Fmanejo-del-expediente-clinico anestesia%- 2F&usg=AOvVaw32JNbK28GXmi9s28Emzj6x
2. Barragán-Solís A, Ramírez-De la Roche OF, Barragán-Solís AN. La anestesiología especialidad de alto riesgo. Un aná- lisis antropológico. Rev Med Hosp Gen Mex. 1998; 61(1): 31-6.
4. Mille-Loera JE, Aréchiga-Ornelas G, Portela-Ortiz JM. Están- dares internacionales para la práctica segura de la aneste- siología. Rev Mex Anest. 2011; 34(11): 84-7.
5. López-Maya L, Lina-Manjarrez F, Lina-López LM. A propósi- to de medicina legal: el anestesiólogo y el expediente clíni- co. Rev Mex Anest. 2016; 39(1): 8-14.
6. NORMA Oficial Mexicana NOM-006-SSA3-2011 [Inter- net]. DOF. 2011 [citado 27 octubre 2021]. Disponible en: https://www.google.com/url?sa=t&rct=j&q=&esrc=s&- source=web&cd=&cad=rja&uact=8&ved=2ahUKEwj- So5WNj6P4AhWOIkQIHVNPCdwQFnoECBAQAw&url=ht- tps%3A%2F%2Fdof.gob.mx%2Fnota_detalle.php%3Fcodi- go%3D5240668%26fecha%3D31%2F12%2F1969&usg=AO- vVaw3ur4mQRwptKQJCLaubvyGY
7. Iriarte-La Fuente D, Torres Salazar J, Melgarejo-Rocha, To- rres Salazar J. Auditoría médica en anestesia. Gac Med Bol. 2009; 32(2): 60-4.
8. Peña-Tatalcha HF. Evaluación de la calidad del expediente clínico en el paciente que ingresa para procedimiento qui- rúrgico anestésico en el Hospital Regional Lic. Adolfo López Mateos. [Tesis de especialidad]. CDMX: UNAM; 2019. Con- sultado 27 de octubre de 2021. Disponible en: https:// www.google.com/url?sa=t&rct=j&q=&esrc=s&source=we- b&cd=&ved=2ahUKEwijteTPj6P4AhUwDEQIHST7DAoQ- FnoECAUQAQ&url=https%3A%2F%2Frepositorio.unam. mx%2Fcontenidos%2Fficha%2Fevaluacion-de-la-cali- dad-del-expediente-clinico-en-el-paciente-que-ingresa-pa- ra-procedimiento-quirurgico-anestesico-3538132%3Fc%- 3Drm960P%26d%3Dfalse%26q%3D*%3A*%26i%3D2%- 26v%3D1%26t%3Dsearch_0%26as%3D0&usg=AOvVaw2P- 5jzbMtKM8pB9teg6Q8L0
9. Hernández-Velazco EM. Apego a la NOM-006-SSA3-2011, del servicio de anestesiología en la Unidad Médica de Alta Especialidad Hospital de especialidades. Educación en el personal becario para la aplicación correcta de la misma. [Tesis de Especialidad]. Puebla: BUAP. 2019. Consulta- do 27 de octubre de 2021. Disponible en: https://www. google.com/url?sa=t&rct=j&q=&esrc=s&source=web&c- d=&ved=2ahUKEwi_4O3sj6P4AhUMJEQIHeUXAuwQFnoE- CAYQAQ&url=https%3A%2F%2Frepositorioinstitucional. buap.mx%2Fhandle%2F20.500.12371%2F9631&usg=AOv-
10. Gómez-Torres J, Márquez-González H, García-Jiménez FE,
Ureña-Borgarín EL. Calidad de las notas pre, trans y posta- nestésicas y su relación con la antigüedad del trabajador. Rev CONAMED. 2014; 19(1): 17-22.
11. Elhalawani I, Jenkins S, Newman N. Perioperative anes- thetic documentation: Adherence to current Australian guides. J Anesthesiol Clin Pharmacol. 2013; 29(2): 211-15. DOI: 10.4103/0970-9185.111726.
12. Carvajal-Oviedo HE, Poppe-Mujica V, Patiño-Michel PA, Campos-Villegas WF, Rivera-Reynoso XC. Expediente clínico y otros documentos médico legales como evidencia de la praxis médica. Arch Bol Med. 2013; 20 (88): 60-73.
13. Tanoubi I. The electronic medical record in anesthesiolo- gy: a standard of quality healtcare and patient safety. Can J Anesthesiology. 2017; 64(7): 693- 7. DOI 10.1007/s12630- 017-0886-0
14. Vargas-Sánchez K, Pérez-Castro, Vázquez JA, Soto-Arreola MO. Cumplimiento de los indicadores del modelo de eva- luación del expediente clínico integrado y de calidad (ME- CIC). Rev CONAMED. 2015; 20(4): 149-59.
15. Curtis WB, Sethi R, Visvanathan T, Sethi S. Perioperative anaesthetic documentation: A report of three sequential audits on the quality of outcomes, with an insight into sur- rounding legal issues. Turk J Anesthesiology Reanimation. 2018; 46(5): 354-61. DOI: 10.5152/TJAR.2018.40222.
Delirium Posanestésico Asociado a Anestesia Regional en cirugía de Cadera en Población Geriátrica
Post-anesthesia Delirium Associated with Regional Anesthesia in Hip Surgery in a Geriatric Population.
Favela-Torres KP1, Mendoza-Gastélum MAC2. 1Médico Especialista en Anestesiología; Hospital General de Zona con Unidad de Quemados No. 14, OOAD, Sonora.México.2Médico residente en Anestesiología; Hospital General de Zona con Unidad de Quemados No. 14, OOAD Sonora, México.
Anestesia en México 2024; 36(2):
Fecha de recepción marzo 2024, fecha de revisión abril 2024, Fecha de publicación mayo 2024 karlapft84@gmail.com
Resumen
Introducción: El delirium es la complicación quirúrgica más común en pacientes de edad avanzada, con una incidencia del 15 al 25 % después de alguna cirugía electiva y 50 % después de algún procedimiento de alto riesgo. Objetivo: Identificar la frecuencia de delirum posoperatorio en cirugía de cadera bajo anestesia regional, en población geriátrica. Material y métodos: Estudio observacional, transversal, descriptivo y prospectivo en adultos mayores, postoperados de cirugía de cadera bajo anestesia regional. Pacientes mayores a 65 años, que requirieron cirugía de cadera, se estudiaron variables clínicas, sociodemográficas y del procedimiento quirúrgico, mediante el examen Minimental de Folstein vs su resultado basal previo al procedimiento quirúrgico. Resultados: Se obtuvo una muestra de 53 pacientes, 69.8
% corresponde a mujeres, del cual el 32.1 % presentaban un estado de delirium en condiciones basales vs 41.5 % y 45.3 % a las 12 y 24 horas del postoperatorio (p<0.001) Conclusiones: La cirugía de cadera bajo anestesia regional en población geriátrica se asocia con DP en hasta 45.3 %. Palabras clave: Adultos mayores; Cirugía de cadera; Delirium.
Abstract
Introduction: Delirium is the most common surgical complication in elderly patients, with an incidence of 15 to 25% after some elective surgery and 50% after some high-risk procedure. Objective: To identify the frequency of postoperative delirum in hip surgery under regional anesthesia, in a geriatric population. Material and methods: Observational, cross-sectional, descriptive
and prospective study in older adults, post-hip surgery under regional anesthesia. In patients over 65 years of age who required hip surgery, clinical, sociodemographic and surgical procedure variables were studied using the Folstein Minimental Examination vs their baseline result prior to the surgical procedure. Results: A sample of 53 patients was obtained, 69.8% corresponded to women, of which 32.1% presented a state of delirium in baseline conditions vs 41.5% and 45.3% at 12 and 24 hours postoperatively (p0.001) Conclusions: Hip surgery under regional anesthesia in the geriatric population is associated with PD in up to 45.3%.
Keywords: Older adults; Hip surgery; Delirium.
Introducción
El delirium posoperatorio (DP) representa una complicación considerable en la atención médica perioperatoria, siendo un problema particularmente prevalente en la población geriátrica sometida a cirugía de cadera. Este trastorno se caracteriza por una alteración de la conciencia y del estado mental, que puede oscilar entre la somnolencia y la excitación, dificultando la recuperación posoperatoria, y aumentando significativamente la morbilidad y mortalidad del paciente (1).
La frecuencia de DP en cirugía de cadera es alta. Varios estudios estiman que este fenómeno puede afectar hasta a un 50 % de los pacientes geriátricos, que se someten a este tipo de procedimiento, dependiendo de factores, como el estado de salud previo, comorbilidades, la duración de la cirugía y el tipo de anestesia administrada (2-3).
Uno de los aspectos claves para comprender y manejar este problema, es la relación entre la anestesia regional y el DP. La evidencia disponible sugiere que la anestesia regional puede reducir la incidencia de delirium, en comparación con la anestesia general en la cirugía de cadera. Sin embargo, esta relación es compleja y está modulada por varios factores, incluyendo el estado de salud del paciente, la técnica de anestesia empleada y el manejo postoperatorio del dolor (4).
El delirium es un síndrome neuropsiquiátrico causado por una perturbación en la fisiología neuronal secundario a una alteración sistémica, cuya característica principal es la alteración de la atención o de la conciencia, la cual se acompaña de un cambio neurocognoscitivo agudo, fluctuante, transitorio, reversible, que no se explica mejor
por un trastorno neurocognoscitivo preexistente o en curso (1-2). Esta entidad clínica es una condición frecuente en adultos mayores hospitalizados. La prevalencia del delirium extra hospitalario es baja, del 1 al 2 %, pero en los servicios de urgencias, el delirium se presenta del 8 a 17 % de los adultos mayores (5).
Un tercio de los pacientes mayores de 70 años atendidos en unidades hospitalarias presentan delirium, la mitad de estos pacientes se encuentran con delirium al momento de su ingreso, la otra mitad la desarrolla durante la hospitalización (1-2). En un estudio realizado en el Hospital General de México, se encontró una incidencia acumulada de delirium en pacientes adultos mayores hospitalizados del 12 %, además de encontrar que la causa más frecuente de delirium fue dolor no controlado. En la literatura se ha descrito que la incidencia de delirium en pacientes hospitalizados varía del 11 al 42 % dependiendo del tipo de población, sin embargo, la incidencia es del 51 % después de una cirugía ortopédica, por fracturas de cadera, algunos otros estudios han referido que la incidencia es de 20-40 % en aquellos pacientes adultos mayores (3-4).
Alrededor de siete millones de pacientes hospitalizados padecen delirium cada año. La incidencia aumenta cuando se tiene una alta carga de comorbilidades como disfunción multiorgánica previa a procedimiento quirúrgico, baja concentración de hemoglobina, fracción de eyección disminuida, estenosis de la arteria carótida, o alta concentración de creatinina sérica. Otro estudio realizado en México reportó una prevalencia de delirium del 37.8 % y una mortalidad final del 17.6 % en aquellos con diagnóstico de fractura de cadera (5-6).
La dificultad del reconocimiento del delirium radica en sus características clínicas y tiene múltiples presentaciones, entre las cuales se encuentra la depresión por las alteraciones afectivas y la hipoactividad, la manía con periodos de agitación, los trastornos psicóticos por las alucinaciones y delirios, trastornos de ansiedad por la inquietud y la hipervigilancia y el deterioro neurocognoscitivo mayor por los déficits cognitivos (7). Uno de los escenarios más comunes, es cuando se presenta un adulto mayor, con datos de confusión, este único síntoma, puede ser debido al delirium, a un trastorno neurocognitivo mayor o a ambos. La alteración en el estado de conciencia es una característica propia
del delirium que (6) es poco común que se presente en el trastorno neurocognitivo mayor, la depresión o algún trastorno psicótico (7).
El riesgo de desarrollar delirium se puede evaluar, según la presencia de factores predisponentes y precipitantes. Un solo factor puede llevar al desarrollo del delirium, sin embargo, en los adultos mayores usualmente es multifactorial, esto explica porque el delirium se desarrolla a menudo en adultos mayores con síndrome de fragilidad, así los factores de riesgo más importantes, son trastorno neurocognitivo mayor o deterioro cognitivo, deterioro funcional, déficit visual, historia de abuso de alcohol, y edad avanzada (más de 70 años) (8-9).
Villalpando y colaboradores, mostraron que la edad avanzada (mayores de 75 años), los días de estancia hospitalaria, un índice de comorbilidad elevado y un hematocrito bajo (menor de 30 %), y aquellos quienes tenían concentraciones séricas de glucosa mayores a 140 mg/dL, contribuyen significativamente a la ocurrencia del delirium, con lo que sugiere que el delirium puede ser un marcador de gravedad de la enfermedad. El sexo masculino, los déficits visuales y auditivos, síntomas depresivos, deterioro cognitivo leve, alteraciones en los estudios de laboratorio y el abuso de alcohol también han sido asociados con el incremento del riesgo (3,10).
Una de las consecuencias de importancia del delirium es el deterioro cognitivo. En un estudio en población de UCI 40 % de los pacientes que desarrollaron delirium, tuvieron puntuaciones de su cognición global 1.5 desviaciones estándar (DE) menores de la media poblacional, y el 26 % tuvo puntuáciones dos DE por debajo de la media poblacional; así mismo la duración prolongada del delirium fue asociada con deterioro cognitivo a los dos y 12 meses posteriores y una peor función ejecutiva a los 3 y 12 meses (11). Los adultos mayores que desarrollan delirium tienen un incremento del riesgo de institucionalización al egreso hospitalario (OR, 2.41; IC 95 %, 1.77 a 3.29) y aquellos que tienen un trastorno neurocognitivo previo incrementa hasta cinco veces (OR 5.0; IC 7 95 %, 2.8 a 8.9; P <0.01), además en estos últimos también se encuentra incrementado los días de estancia y reingreso hospitalarios (12).
En un metaanálisis de Pitkala y colaboradores, encontraron que el delirium en adultos mayores con fragilidad, es un predictor para institucionalización permanente (OR 2.45, IC 95 %, 1.2 a 4.9). En la unidad de cuidados intensivos
El DP es un tema de particular valor, debido a los múltiples factores precipitantes que ocurren alrededor de los procedimientos, y aumenta su importancia en los adultos mayores, debido a la susceptibilidad característica de este grupo. El número de adultos mayores que se someten a cirugía se ha incrementado en años recientes debido a dos razones: el envejecimiento poblacional y a los avances en las técnicas quirúrgicas y anestésicas. Actualmente uno de cada tres procedimientos quirúrgicos se realiza en pacientes mayores de 65 años, principalmente por el crecimiento poblacional de dicho grupo (14).
Los adultos mayores tienen el índice más alto de complicaciones posoperatorias que cualquier otro grupo de edad, la cual se define como aquella eventualidad que ocurre en el curso previsto de un procedimiento quirúrgico con una respuesta local o sistémica que puede retrasar la recuperación, poner en riesgo una función o la vida la incidencia; de estas complicaciones va del 20 al 50 % en los pacientes mayores a 80 años, que son mayores en comparación a grupos de edades más jóvenes en donde llega solo a la mitad de estos (15).
El DP es la complicación quirúrgica más común en pacientes de edad avanzada, con una incidencia del 15 al 25 % después de alguna cirugía electiva y 50 % después de algún procedimiento de alto riesgo como reparación de fractura de cadera y cirugía cardiaca; en nuestro país los estudios han revelado una prevalencia del 12 %, de este porcentaje, el 50 % de ellos se habían sometido a intervenciones quirúrgicas, el desarrollo de delirium en este último grupo de pacientes varia en función del tipo ocho de cirugía; la cirugía abdominal con un 17 a 51 %, reemplazo de cadera 35 %; y pacientes posoperados de trasplante renal de 73 % (15-16).
La incidencia del DP varía dependiendo la edad del paciente, el estado prequirúrgico, si la cirugía es electiva o urgente, el tipo de cirugía, y el desarrollo de complicaciones posquirúrgicas. En general, los pacientes adultos mayores se someten a cirugías de urgencia o de larga duración, los procedimientos quirúrgicos complicados tienden a tener mayor frecuencia de delirium (15-16).
En el Hospital de Especialidades de Centro Médico Nacional Siglo XXI, se encontró́ una prevalencia general de DP en pacientes mayores de 60 años del 10.94 %, de todos los servicios, el servicio de Angiología presentó el mayor porcentaje de pacientes con delirium con un 42.86 %; el porcentaje mayor de delirium se presentó́
entre las 48 y 72 horas después de la cirugía. La literatura internacional ha mostrado que por lo menos dos de cada tres casos de delirium se desarrollan en los primeros dos días posquirúrgicos, con un pico de incidencia el primer día posquirúrgico (17-18). ́
En un metaanálisis, se identificó que el deterioro cognitivo en los pacientes posoperados que desarrollaron delirium, se presenta en más del 50 % de estos pacientes, y que este deterioro continua al año de seguimiento; así ́ mismo la función física permanece deteriorada 30 días después del egreso hospitalario tanto en pacientes quirúrgicos como no quirúrgicos que desarrollaron delirium (1,19) y se ha asociado con resultados quirúrgicos pobres, incremento de dos a cinco veces dé riesgo de complicaciones mayores posquirúrgicas y muerte. Así mismo se ha asociado a una menor recuperación funcional posterior a la cirugía a los seis meses de seguimiento. Todas las consecuencias derivadas del delirium postoperatorios, incrementan los costos dentro del primer año posquirúrgico (20-21,9).
Las fracturas de cadera son de las patologías más frecuentemente asociadas con el adulto mayor, debido a la presencia de osteopenia y osteoporosis. Esta situación trae como consecuencia la necesidad de intervención quirúrgica en este grupo de pacientes. Además, se espera que para el año 2050 el número de intervenciones por fractura de cadera se incremente hasta siete veces.
Planteamiento del problema:
En México, se ha reportado una prevalencia cercana al 40 % de los adultos mayores hospitalizados, de los cuales casi la mitad tienen factores predisponentes. Pese a su alta frecuencia, esté no es reconocido por los médicos en el 50 a 80 % de los casos. (15-18).
No existe hasta el momento un estudio en nuestro hospital que haya explorado o demostrado la frecuencia para delirium en cirugía de cadera.
Con esta información se podrá́ comprender el problema, a nivel local, que definirá futuras líneas de investigación. Por estos argumentos, nos planteamos la siguiente pregunta de investigación:
¿Cuál es la asociación de delirum posoperatorio en cirugía de cadera bajo anestesia regional en población geriátrica? (10).
Justificación:
El DP se ha asociado con aumento de estancia intrahospitalaria postquirúrgica, aumento de costo y riesgo elevado de readmisión. Estudios previos reportan que el delirium es prevenible en el 30-40 % de los casos. Los resultados de la presente investigación servirán
como punto de partida para realizar intervenciones a los pacientes con riesgo de presentar esta complicación. (11).
Material y Métodos
Se realizó un estudio descriptivo, transversal y prospectivo en pacientes mayores de 65 años sometidos a anestesia regional, con postoperatorio de cirugía de cadera. Se estudiaron 53 pacientes de ambos sexos, de casos consecutivos. En el Hospital General de Zona No. 14 con unidad de quemados, en Hermosillo. No se incluyeron aquellos pacientes con enfermedad psiquiátrica previa a la cirugía.
El instrumento de evaluación fue el examen Minimental de Folstein (Tabla 5), es un examen de tamiz dentro de las escalas cognitivas-conductuales para confirmar y cuantificar el estado mental de una persona, evalúa las funciones mentales superiores, orientación, registro de información, atención, cálculo, recuerdo, lenguaje y construcción, cada ítem tiene una puntuación, llegando a un total de 30 puntos.
Entre 30 y 27 puntos: no existe deterioro cognitivo, 26 y 25 puntos: probabilidad de existir un posible deterioro 19 cognitivo, 24 y 10 puntos: deterioro cognitivo de leve a moderado, 9 y 6 puntos: deterioro cognitivo de moderado a severo y menos de 6 puntos: Deterioro cognitivo severo (22). (Anexo 2), (20). Aspectos éticos: El estudio fue autorizado por el comité de investigación en salud y por el comité local de Investigación del IMSS.
Resultados:
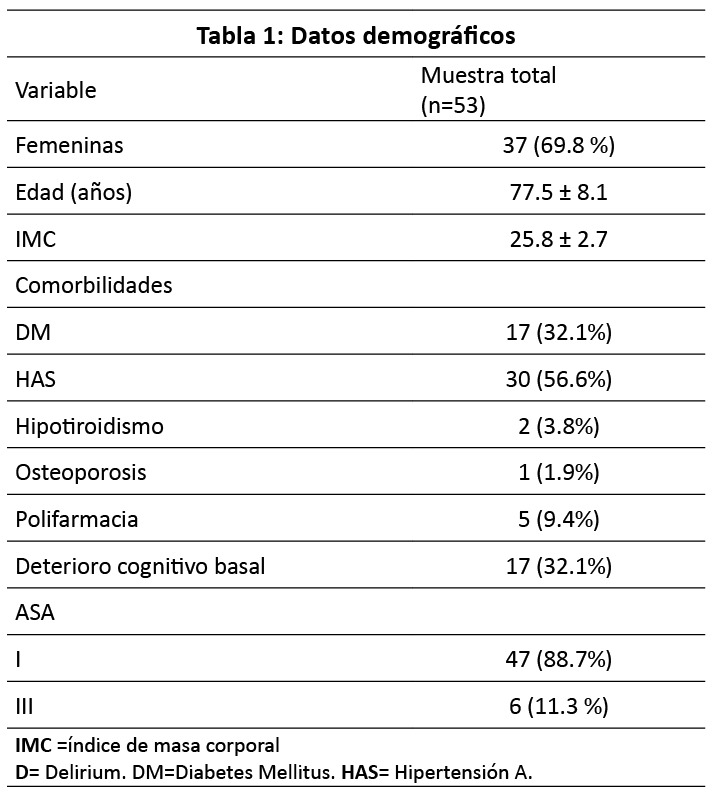
De los 53 sujetos, el 69.8 % (n= 37) fueron pacientes del sexo femenino, se obtuvo una media para la edad de 77.5 ± 8.1 años (con un rango de 63 a 100 años), La media para índice de masa corporal (IMC) fue 25.8 ± 2.7 kg/m2 (con un rango de 20 a 32 kg/m2), 88.7 % fueron riesgo ASA II (el 11.3 % restante ASA III). Las variables demográficas se presentan en la (Tabla 1). Se crearon rangos de edad para identificar rango más frecuente de presentación de DP, siendolosrangosde60a69años,70a79,80a89y90a 100 años.
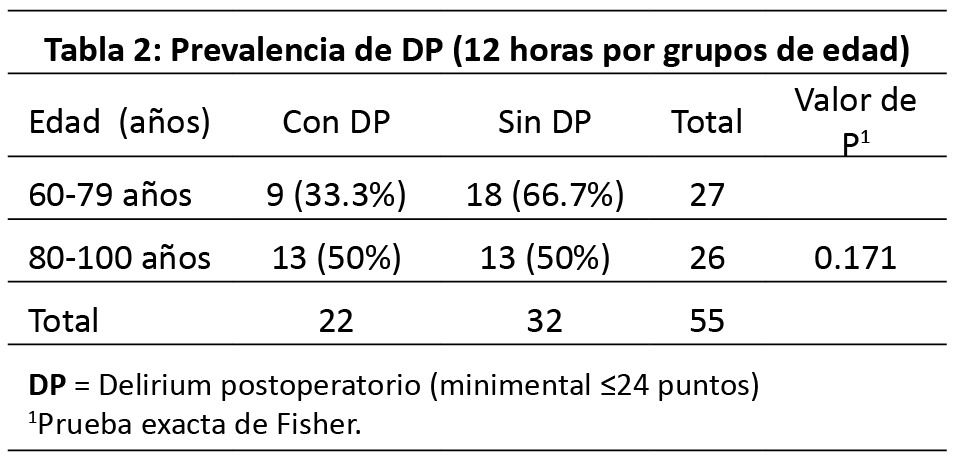
Se comparó la frecuencia de DP a las 12 horas según rango de edad mediante Xi2, de 80 a 89 años, se presentó la mayor frecuencia con 12 pacientes (50 %, p=0.545). Al establecer como punto de corte los 80 años (< 80 años vs ≥ 80 años), se presentó mayor prevalencia en los pacientes de 80 años o más (50 % vs 33.3 %, mediante prueba exacta de Fisher, p=0.171).
En la (Tabla 2), se compara la prevalencia de DP según edad (<80 años vs ≥ 80 años). Se comparó la frecuencia de DP a las 24 horas según rango de edad mediante Xi2, de 80 a 89 años se presentó la mayor frecuencia con nueve pacientes (37.5 %, p=0.652). Al establecer como punto de corte los 80 años (<80 años vs ≥ 80 años), se presentó mayor prevalencia en los pacientes de 80 años o más, sin lograr la significancia estadística con prueba exacta de Fisher (38.5 % vs 25.9 %, p=0.248).
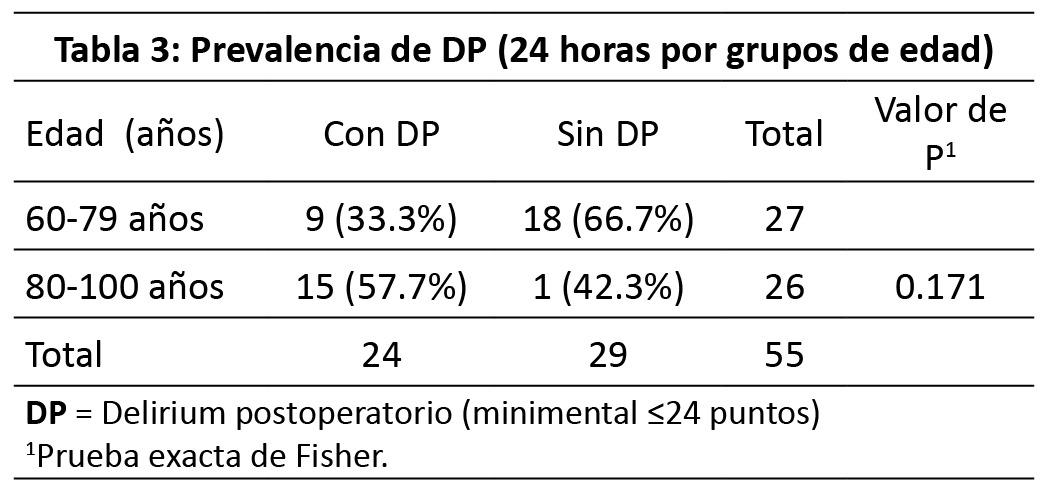
En la (Tabla 3), se compara la prevalencia de DP según edad (<80 años vs ≥ 80 años). 26 A las 12 horas, las pacientes del género femenino presentaron mayor proporción de pacientes con DP en comparación con los hombres (43.2 % vs 18.8 %), a las 24 horas las pacientes del género femenino continuaron con mayor proporción de DP (48.6 % vs 37.5 %). Sin embargo, ninguno de estos hallazgos fue estadísticamente significativo (mediante prueba exacta de Fisher, p=0.768 y 0.554, respectivamente).
La función cognitiva fue evaluada en tres tiempos: basal, 12 horas y 24 horas, en el basal se obtuvo una mediana de 25 puntos (RIQ 24-26) con un mínimo de 23 y máximo de 27 puntos. A las 12 horas se obtuvo una mediana de 25 puntos (RIQ 24-26) con un mínimo de 21 y máximo de 27 puntos. A las 24 horas fue una mediana de 25 puntos (RIQ 23-25.5) con un mínimo de 21 y máximo de 26 puntos. De acuerdo con la prueba de rangos de Wilcoxon para comparar los puntajes del Minimental basal vs 12 y 24 horas postoperatorias, el puntaje del Minimental postoperatorio, tanto a las 12 como a las 24 horas, no difiere con respecto al preoperatorio en cirugía de cadera (p<0.001). De los 53 pacientes, 17 (32.1 %) presentó puntaje de Minimental compatible con Delirium en su
basal, a las 12 horas se presentó una prevalencia de 22 pacientes (41.5 %) con DP y a las 24 horas incrementó a 24 pacientes (45.3 %).
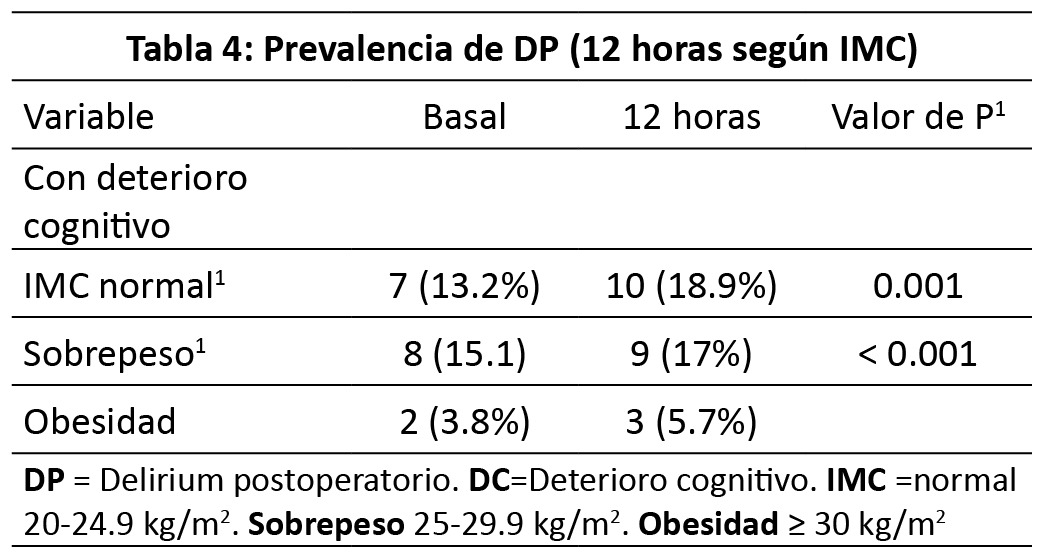
Estas diferencias en la prevalencia de DP con respecto a su basal fueron comparadas mediante prueba exacta de Fisher y fueron estadísticamente significativas tanto para las 12 como 24 horas (p<0.001 en ambos casos) (27). Para comparar el IMC entre los pacientes que desarrollaron DP se crearon los siguientes rangos: normal de 20 a 24.9, sobrepeso de 25 a 29.9 y obesidad de 30 o más. A las 12 horas el grupo de IMC con mayor prevalencia de DPO fue IMC normal con 10 (45.5 %) (p=0.040) y a las 24 horas también con 12 (50 %) (p=0.023). En la (Tabla 4 y 5), se comparan los pacientes con DP a las 12 y 24 horas según IMC. De los 22 pacientes que presentaron DP a las 12 horas, nueve pacientes (40.9 %) padecen diabetes, y 15 pacientes (68.2 %) padecen hipertensión arterial sistémica, al comparar la diferencia de prevalencia con los pacientes sin DP no se encontraron diferencias estadísticamente significativas mediante prueba exacta de Fisher (diabetes p=0.371 y HAS p=0.173). De los 24 pacientes que presentaron DP a las 24 horas, nueve pacientes (37.5 %) padece diabetes (p=0.557), y 16 pacientes (66.7 %) tuvieron hipertensión arterial sistémica, al comparar la diferencia de prevalencia con los pacientes sin DP no se encontraron diferencias estadísticamente significativas mediante prueba exacta de Fisher (diabetes p=0.557 y HAS p=0.266). De los 21 pacientes con hipotensión transoperatoria, nueve pacientes (42.9 %) presentó DP a las 12 horas, y 10 pacientes (47.6 %) a las 24 horas; estas diferencias no fueron significativas a las 12 ni a las 24 horas mediante prueba exacta de Fisher (p=1.0 para ambos casos). El riesgo de presentar DP a las 12 y 24 horas con respecto a presentar hipotensión transoperatoria no fue significativo, RR 1.055 IC95 % 0.552-2.016 y RR 1.088 IC95 % 0.6-1.976 respectivamente (28). Los pacientes del estudio presentaron una clasificación ASA II o III. De los pacientes con ASA II, 19 (40.4 %) desarrollaron DP a las 12 horas, mientras que de los pacientes con ASA III, 3 (50 %) presentó DP a las 12 horas, estas diferencias no fueron estadísticamente significativas mediante prueba exacta de Fisher (p=1 y 0.588 respectivamente). Con respecto al desarrollo de DP a las 24 horas, de los pacientes con ASA II fueron 20 pacientes (42.6 %) y de los pacientes con ASA III fueron cuatro pacientes (66.7 %).
Estas diferencias no fueron estadísticamente significativas mediante prueba exacta de Fisher (p=0.683 y 0.392 respectivamente) Se analizó correlación, mediante Rho de Spearman entre puntaje de Minimental postoperatorio y dosis de Benzodiacepinas. Se detectó una correlación positiva débil con tendencia a la significancia (coeficiente de correlación 0.265, p=0.056).
No se detectó una relación lineal entre las dosis de midazolam y el puntaje de Minimental postoperatorio (R 0.292, R2 0.085, p 0.034). No se detectó correlación entre las dosis de ropivacaína y puntaje de Minimental (coeficiente de correlación -0.037, p 0.791). No se detectó correlación entre la dosis de bupivacaina y el puntaje de Minimental (coeficiente de correlación 0.243, p 0.080). No se analizó relación lineal del puntaje de Minimental y dosis de bupivacaina o ropivacaína dada la falta de correlación entre dichas variables.
Los pacientes que desarrollaron DP a las 12 y 24 horas, sólo tres (60 %) presentaron polifarmacia (definido en nuestro estudio como el uso de cuatro o más medicamentos simultáneos). Estas diferencias no fueron estadísticamente significativas mediante prueba exacta de Fisher (p=0.638 y 0.649 respectivamente) 29 de los pacientes, 36 pacientes (67.9 %) refirieron un EVA posoperatorio de 0, dos pacientes (3.8 %) un EVA de uno, diez pacientes (18.9 %) un EVA de dos, cuatro pacientes (7.5 %) un EVA de tres y sólo uno paciente (1.9 %) refirió un EVA de cuatro. De los pacientes con DP a las 12 horas, 15 (68.2 %) no refirió dolor (EVA 0 puntos) y siete (31.8 %) refirió dolor leve (EVA 1-3 puntos). De los pacientes con DP a las 24 horas, 16 (66.7 %) no refirió dolor (EVA 0 puntos) y ocho (33.3 %) refirió dolor leve (EVA 1-3 puntos). Ningún paciente con DP refirió EVA de cuatro puntos o más 30 Discusión Se ha observado una prevalencia baja de delirium en población geriátrica de hasta 17 % de los adultos mayores hospitalizados, sin embargo, nuestra muestra presentó casi el doble de dicha prevalencia, con 32.1 % en su basal.
Discusión
Dada la naturaleza multifactorial del DP, su prevalencia varía según distintos autores, tomando en cuenta características del paciente como sexo, edad y comorbilidades, o bien propias de la cirugía o relacionadas con complicaciones transoperatorias.
Para comparar la prevalencia de nuestros resultados con los de otros autores, debemos tomar en cuenta las características de nuestra muestra e intervenciones. Por ejemplo, Torres-Pérez y cols detectaron en adultos mayores mexicanos postoperados de fractura de cadera, una prevalencia de DP de 37.8 %, vs hasta 45.3 % detectado en nuestro estudio. Sin embargo, DP no fue evaluado con la misma herramienta.
Además, ellos evaluaron DP a los meses, en comparación con las 12 y 24 horas de nosotros, y hay que recordar que DP es una entidad posiblemente reversible con respecto al tiempo transcurrido. El tiempo de evaluación de DP es importante, un estudio realizado en el Hospital de Especialidades de Centro Médico Nacional Siglo XXI, que el mayor porcentaje de pacientes con delirium fue entre las 48 y 72 horas después de la cirugía.
En contraste con los resultados de Torres-Pérez, encontraron una prevalencia muy similar a la de nuestro estudio, con 42.86 % En nuestro estudio se exploró la asociación de otras variables, como por ejemplo el sexo. El sexo masculino se ha asociado con incremento del riesgo para DP, sin (31) embargo, en nuestro estudio se encontró mayor prevalencia en mujeres que hombres, aunque esto no fue estadísticamente significativo.
La edad también se ha asociado como factor de riesgo para DP, en nuestro estudio encontramos los 80 años como el punto de inflexión para incrementar el riesgo de DP. Los pacientes con IMC normal presentaron mayor prevalencia de DP en comparación con sobrepeso y obesidad, tanto a las 12 y 24 horas. La comorbilidad con mayor frecuencia en los pacientes con DP fue HAS con 68.2 %, sin embargo, no se asoció con mayor riesgo de DP. Tampoco se asociaron las otras comorbilidades, DM, Hipotiroidismo y Osteoporosis con mayor riesgo de presentar DPO.
La hipotensión transoperatoria no fue un factor de riesgo para el desarrollo de DP a las 12 ni a las 24 horas del postoperatorio. El estado físico por clasificación de ASA, tampoco se asoció con mayor riesgo de desarrollar DP a las 12 ni 24 horas. La dosis en mg de benzodiacepinas se correlacionó de manera débil con el puntaje en el test Minimental de Folstein (Rho= 0.265, p=0.056), sin embargo, no se detectó una relación lineal entre dosis de mg utilizados y el puntaje de Minimental postoperatorio (R 0.292, R2 0.085, p 0.034).
Las dosis de ropivacaína y bupivacaina) no se
correlacionaron con el puntaje de Minimental (Rho -0.037, p 0.791 y Rho 0.243, p 0.080 respectivamente). El uso de cuatro o más medicamentos no se asoció con mayor riesgo de DP (32). Villalpando-Berumen y cols observaron en adultos mayores mexicanos, que la causa más frecuente de DP en pacientes hospitalizados fue dolor no controlado. Nuestros resultados no encontraron asociación entre puntaje EVA y DP, sin embargo, ninguno de los pacientes llegó a referir dolor moderado o severo, sólo dolor leve y la gran mayoría refirió EVA de 0. Esto posiblemente asociado al uso de anestesia regional y el tiempo de evaluación de DP de 12 y 24 horas, donde el dolor postoperatorio puede ser mejor controlado con anestesia regional.
No se detectaron diferencias entre la basal y las 12 y 24 horas de postoperatorio. Sin embargo, el test Minimental de Folstein establece como punto de corte para deterioro cognitivo, presentar 24 o menos puntos, y al comparar la prevalencia de DP a las 12 y 24 horas del postquirúrgico vs la basal, se encontró una diferencia estadísticamente significativa. Siendo a las 24 horas la mayor prevalencia de DP (45.3 % vs 32.1 % de su basal) (33).
Al inicio de nuestro estudio y en relación a las observaciones de los autores anteriormente revisados se pensó que la variable hipotensión seria asociada estrechamente a la presentación de delirio postanestesico, esto debido a la vasodilatación secundaria a la aplicación de anestesia regional tipo subaracnoidea, sin embargo mientras se estudiaba a cada una de las variables no se encontró correlación importante con respecto a los efectos hemodinámicos (hipotensión) secundaria a aplicación de anestesia neuroaxial.
Conclusiones:
una prevalencia máxima superior al 40 %, por lo cual se acepta la hipótesis de investigación. Nuestro estudio estuvo limitado con respecto a un grupo control, se sugieren investigaciones futuras que comparen la presencia de DP en pacientes con anestesia regional vs anestesia general.
Referencias
1. Inouye SK, Westendorp RG, Saczynski JS. Delirium in elder- ly people. Lancet. 2014;383(9920):911-922. DOI: 10.1016/ S0140-6736(13)60688-1
2. Marcantonio ER. Delirium in Hospitalized Older Adults. N Engl J Med. 2017;377(15):1456-1466. DOI: 10.1056/NEJM- cp1605501
3. Villalpando-Berumen JM, Pineda-Colorado AM, Palacios
P, Reyes-Guerrero J, Villa AR, Gutiérrez-Robledo LM. Inci- dence of delirium, risk factors, and long-term survival of elderly patients hospitalized in a medical specialty teaching hospital in Mexico City. Int Psychogeriatric. 2003;15(4):325- 336. DOI: 10.1017/s104161020300958x
4. Wang CG, Qin YF, Wan X, Song LC, Li ZJ, Li H. Incidence and risk factors of postoperative delirium in the elderly pa- tients with hip fracture. J Orthop Surg Res. 2018;13(1):186. DOI: 10.1186/s13018-018-0897-8
5. Adamis D, Treloar A, Martin FC, Macdonald AJ. A brief review of the history of delirium as a mental disorder. Hist Psychiatry. 2007;18(72):459-469. DOI: 10.1177/0957154X07076467
6. Torres-Pérez JF, Jimenez-Gomez JC, Vazquez-Garcia A, Gua- jardo-Alvarez G, Platt-Soto J, Mercado-Quintero MB, et al. Prevalencia De Delirium En Adultos Mayores Con Fractura De Cadera. Medicina Universitaria. 2010;12(49):203-208.
7. Oh ES, Fong TG, Hshieh TT, Inouye SK. Delirium in Older Persons: Advances in Diagnosis and Treatment. JAMA. 2017;318(12):1161-1174. DOI: 10.1001/jama.2017.12067
8. Van Munster BC, de Rooij SE, Korevaar JC. The role of genet- ics in delirium in the elderly patient. Dement Geriatr Cogn Disord. 2009;28(3):187-195. DOI: 10.1159/000235796
9. Álvarez-Bastidas L, Valle-Leal JG, Morales-Vera E, Marro- quín-González J. Delirium en el adulto mayor sometido a anestesia: Factores asociados. Rev Colomb Anestesiología. 2018;46(4):273-278. https://www.revcolanest.com.co/in- dex.php/rca/article/view/302
10. Trzepacz PT, Meagher DJ, Franco JG. Comparison of di- agnostic classification systems for delirium with new re- search criteria that incorporate the three core domains. J Psychosom Res. 2016;84:60–8. 26 DOI: 10.1016/j.jpsy- chores.2016.03.011
11. LiY,MaJ,JinY,LiN,ZhengR,MuW,etal.Benzodiazepines for treatment of patients with delirium excluding those who are cared for in an intensive care unit. Cochrane Database Syst Rev. 2020;2(2):CD012670. DOI: 10.1002/14651858. CD012670.pub2
12. Witlox J. Delirium in Elderly Patients and the Risk of Postdischarge Mortality. JAMA. 2015;304(4):443–51. DOI: 10.1001/jama.2010.1013
13. Pitkala KH, Laurila JV, Strandberg TE, Tilvis RS. Prog- nostic significance of delirium in frail older people. Dement Geriatr Cogn Disord. 2005;19(2-3):158-163. DOI: 10.1159/000082888
14. Nazemi AK, Gowd AK, Carmouche JJ, Kates SL, Albert TJ, Behrend CJ. Prevention and Management of Postoperative Delirium in Elderly Patients Following Elective Spinal Sur- gery. Clin Spine Surg. 2017;30(3):112-119. DOI: 10.1097/ BSD.0000000000000467
15. López-Jaime MA, Vázquez-Estupiñan F, Aguilar-Madrid G,
Cooper-Bribiesca D, Juárez-Pérez C. Prevalencia de delirium postquirúrgico y su relación con disfunción ejecutiva pre- quirúrgica en pacientes mayores de 60 años del hospital de especialidades CMN siglo XXI. Vertientes. 2013;15(2):1-6.
16. Ellard L, Katznelson R, Wasowicz M. Type of anesthesia and postoperative delirium after vascular surgery. J Cardio- thorac Vasc Anesth. 2014;28(3):458-461. DOI: 10.1053/j. jvca.2013.12.003
17. Reade MC, Finfer S. Sedation and Delirium in the In- tensive Care Unit. N Engl J Med. 2014;370(5):444–54. DOI: 10.1056/NEJMra1208705
18. Hong N, Park JY. The Motoric Types of Delirium and Esti- mated Blood Loss during Perioperative Period in Orthope- dic Elderly Patients. Biomed Res Int. 2018;2018:9812041. DOI: 10.1155/2018/9812041
19. Vlisides P, Avidan M. Recent Advances in Preventing and Managing Postoperative Delirium. F1000Res. 2019;8:607. DOI: 10.12688/f1000research.16780.1
20. Reddy SV, Irkal JN, Srinivasamurthy A. Postoperative deli- rium in elderly citizens and current practice. J Anaesthesiol Clin Pharmacol. 2017;33(3):291-299. DOI: 10.4103/joacp. JOACP_180_16
21. Jin Z, Hu J, Ma D. Postoperative delirium: perioperative as- sessment, risk reduction, and management. Br J Anaesth. 2020;125(4):492-504. DOI: 10.1016/j.bja.2020.06.063
22. Folstein MF, Folstein SE, McHugh PR. “Mini-mental state”. A practical method for grading the cognitive state of pa- tients for the clinician. J Psychiatr Res. 1975;12(3):189-198. DOI: 10.1016/0022-3956(75)90026-6
Adicción a las Redes Sociales de los Médicos Residentes de Anestesiología en un Hospital de Tercer Nivel.
Social Media Addiction Among Anesthesiology Resident Physicians in a Tertiary Care Hospital.
1Daniel Roberto Castillo-García. Departamento de anestesiología, Hospital de Especialidades “Dr. Bernardo Sepúlveda Gutiérrez” del Centro Médico Nacional “Siglo XXI” del Instituto Mexicano del Seguro Social. Ciudad de México. ORCID: https://orcid.org/0009-0000- 0468-4647
2Oscar Eduardo García-Sagundo. Departamento de anestesiología, Hospital de Especialidades “Dr. Bernardo Sepúlveda Gutiérrez” del Centro Médico Nacional “Siglo XXI” del Instituto Mexicano del Seguro Social. Ciudad de México.
3Víctor León-Ramírez. Jefatura de Quirófanos, Hospital de Especialidades “Dr. Bernardo Sepúlveda Gutiérrez” del Centro Médico Nacional “Siglo XXI” del Instituto Mexicano del Seguro Social. Ciudad de México. ORCID: https://orcid.org/0000-0002-3213-5650 3María del Rocío Courdurier-Ortega. Jefatura de Anestesiología, Hospital de Especialidades “Dr. Bernardo Sepúlveda Gutiérrez” del Centro Médico Nacional “Siglo XXI” del Instituto Mexicano del Seguro Social. Ciudad de México.
4Janaí Santiago-López. Departamento de anestesiología, Hospital de Cardiología del Centro Médico Nacional “Siglo XXI” del Instituto Mexicano del Seguro Social. Ciudad de México.ORCID: https://orcid.org/0000-0002-9278-1590
Anestesia en México 2024;36(2):
Fecha de recepción marzo 2024, fecha de revisión abril 2024, fecha de publicación danncastig@gmail.com
Resumen
Introducción: La adicción a las redes sociales afecta a los profesionales de la salud y se reconoce como un problema importante de salud mental. Esto es especialmente relevante para los médicos en formación en anestesiología, quienes enfrentan altos niveles de estrés y requieren habilidades cognitivas y manuales óptimas. Reconocer y gestionar adecuadamente esta adicción es esencial para mejorar el proceso de aprendizaje y reducir los
riesgos asociados en este contexto exigente y dinámico. Objetivo: Determinar la prevalencia de la adicción a las redes sociales de los médicos residentes de anestesiología en nuestra institución hospitalaria. Material y métodos: Realizamos un estudio transversal descriptivo en un grupo de 50 residentes de anestesiología. Utilizamos la escala de adicción a las redes sociales de Sahin, adaptada a población mexicana, que evaluó cuatro aspectos: problemas, satisfacción, obsesión por estar informado y necesidad de
Palabras clave: Redes sociales; Internet; tecnologías de la información y la comunicación; Adicción; Educación médica.
Abstract
Introduction: Social media addiction impacts healthcare professionals and is recognized as a significant mental health issue. This is particularly relevant for anesthesiology trainees who face high-stress levels and require optimal cognitive and manual skills. Recognizing and properly managing this addiction is essential to enhance the learning process and reduce associated risks in this demanding and dynamic context. Objective: To determine the prevalence of social media addiction among anesthesiology resident physicians in our hospital institution. Materials and Methods: We conducted a descriptive cross-sectional study among a group of 50 anesthesiology residents. We utilized Sahin’s Social Media Addiction Scale, adapted for the Mexican population, which assessed four aspects: problems, satisfaction, obsession with being informed, and the need to be connected. We calculated the degree of addiction based on the scores obtained. We analyzed the internal validity of the instrument using Cronbach’s alpha. Data were processed using SPSS v-27, obtaining means and frequencies for the addiction scale variables. Results: The tool used demonstrated high reliability with a Cronbach’s alpha of 0.910. A prevalence of 48% of social media addiction was observed among anesthesiology resident physicians. The average score on the SMAS- SF questionnaire adapted for the Mexican population was 56.5 [interquartile range: 46.75-74]. Conclusion:
Anesthesiology resident physicians exhibit considerable addiction to the internet, primarily in mild forms. Keywords: Social media; Internet; Information and communication technologies; Addiction; Medical education.
Introducción
La rápida evolución de las tecnologías de la información y la comunicación en las últimas décadas ha generado cambios significativos en la forma en que vivimos y en nuestra realidad social. Estas tecnologías están siendo empleadas para ejercer control sobre diversos aspectos de nuestra vida, como la naturaleza, el tiempo, la distancia y nuestras interacciones sociales. Aunque estas herramientas tienen el potencial de mejorar nuestras capacidades humanas, como la física, la sensorial y la mental, su uso, especialmente el de Internet, ha generado paradojas en relación con el cerebro, la memoria y la lectura. Es esencial reflexionar sobre cómo nuestras prácticas digitales afectan nuestras habilidades y evaluar su impacto en nuestra salud mental (1).
La perpetración masiva de Internet ha experimentado un crecimiento exponencial, entre el 55 % y el 82 % de adolescentes y adultos navegando regularmente. Este medio ofrece una amplia gama de actividades, algunas de las cuales pueden presentar riesgos de adicción (2).
La adicción a Internet es un exceso en el uso de tecnología, con variantes como adicción a la computadora, sobrecarga de información, compulsiones de la red, adicción cibersexual y adicción a relaciones cibernéticas. Las redes sociales se ubican en la última categoría debido a su propósito principal de establecer y mantener relaciones en línea y fuera de ella (2,3).
Por supuesto. Las redes sociales son plataformas que permiten interacciones virtuales entre individuos basadas en intereses comunes, creando comunidades globales. A través de perfiles públicos, los usuarios pueden conectarse con amigos reales y conocer nuevos contactos. Este fenómeno, reconocido como un aspecto crucial del consumo contemporáneo, aprovecha la infraestructura web para facilitar la construcción de perfiles, conexiones y el intercambio de contenido multimedia, reflejando los principios de la Web 2,0 (2,3).
En el ámbito educativo, las redes sociales son esenciales como canales de comunicación y apoyo
La adicción a las redes sociales se considera una adicción conductual que requiere una evaluación desde una perspectiva biopsicosocial. Los adictos a las redes sociales presentan síntomas similares a los adictos a sustancias, incluyendo cambios de humor, aumento de la prioridad dada a la actividad, tolerancia, síntomas de abstinencia, conflicto y recaída. Esto puede llevar a consecuencias negativas como mayor aislamiento social, ansiedad y deterioro académico (2,3,7-10).
Esta adicción también conlleva trastornos físicos y cambios en el cerebro, con múltiples condiciones comórbidas. Los estudiantes son especialmente afectados, con una prevalencia del trastorno que varía del 1,8 al 34 %, dependiendo de factores como género, ubicación y nivel académico (11,12).
El uso excesivo de redes sociales está asociado con bajo rendimiento académico en estudiantes. Aquellos que las utilizan más que la media suelen mostrar falta de concentración en clase, obteniendo calificaciones inferiores o enfrentando la repetición de cursos (4,13,14). Es crucial evaluar la adicción a las redes sociales. Se han desarrollado diversas escalas para este fin, como la Escala de Adicción a Facebook de Bergen (BSMAS), la Escala
SNAddS-6S, la Escala de Adicción a las Redes Sociales (SNAS), la Escala de Riesgo de Adicción-Adolescente a las Redes Sociales e Internet (ERA-RSI), y la Escala de Adicción a las Redes Sociales de Sahin, incluyendo su adaptación a la población mexicana, entre otras (9,15-17). La adaptación de la Escala de Adicción a las Redes Sociales de Sahin para la población mexicana fue validada en 17,600 estudiantes de preparatoria, tanto en modalidad en línea como presencial. Demostró una alta fiabilidad y correlación, fortaleciendo su utilidad en la evaluación de la adicción a las redes sociales en este contexto (17). Debido a que la adicción a Internet y las redes sociales afecta a profesionales de la salud, siendo reconocida como un grave problema de salud mental. Sus efectos negativos y consecuencias adversas han llevado a su inclusión en la Clasificación Internacional de Enfermedades (ICD-11) y en el Manual Diagnóstico y Estadístico de los Trastornos Mentales (DSM-5) (18,19). La adicción a Internet y las redes sociales conlleva riesgos significativos para la salud mental y el comportamiento, como síntomas depresivos y de ansiedad, deterioro cognitivo, fatiga, problemas de sueño y reducción del rendimiento. Esto es particularmente relevante para el personal médico en formación, cuyo trabajo en entornos estresantes demanda un óptimo funcionamiento cognitivo y manual. Es crucial investigar estos aspectos, ya que pueden afectar negativamente su proceso de aprendizaje.18,20,21 Además, es conocido que el personal médico en formación enfrenta un mayor riesgo de problemas de salud mental, como suicidio, depresión, trastornos depresivos y abuso de sustancias. Reconocer y manejar la adicción a Internet en estos profesionales puede optimizar su aprendizaje y reducir otros riesgos para la salud mental (18) Esto subraya la importancia de abordar este tema en nuestra investigación.
Material y métodos:
Con la aprobación del Comité Local de Investigación en Salud (CLIES) con número de registro R-2022-3601-231, y el consentimiento informado de los participantes, Se llevó a cabo un estudio en 50 residentes de anestesiología para investigar la prevalencia de la adicción a las redes sociales en nuestra institución hospitalaria. Los participantes fueron convocados en el aula de enseñanza donde recibieron una explicación detallada del estudio y tuvieron la oportunidad de plantear preguntas antes de
decidir participar, firmando un consentimiento informado. Luego, completaron un cuestionario basado en la escala de adicción a las redes sociales de Sahin adaptada para la población mexicana (17). El grado de adicción se definió en función del puntaje total obtenido a la aplicación del instrumento: Sin adicción (28-57), adicción leve (58-85), adicción moderada (86-112) y adicción grave (113-140).
La duración estimada para responder el instrumento fue de una hora y se aplicó al inicio de la jornada académica. Se aseguró la confidencialidad de las respuestas y se recopilaron en una base de datos electrónica para su análisis estadístico.
Inicialmente se llevó a cabo un análisis descriptivo. Se emplearon medidas de tendencia central y dispersión para variables dimensionales, presentando los datos como promedio ± desviación estándar o mediana con percentiles 25-75, dependiendo de la distribución paramétrica o no paramétrica. Las variables nominales se expresaron como razones y proporciones. Para evaluar la validez interna del instrumento, se calcularon el coeficiente alfa de Cronbach y la correlación de Pearson. El procesamiento de los datos se llevó a cabo utilizando el software SPSS (SPSS, inc. Chicago, IL, USA) versión 27,0.
Resultados
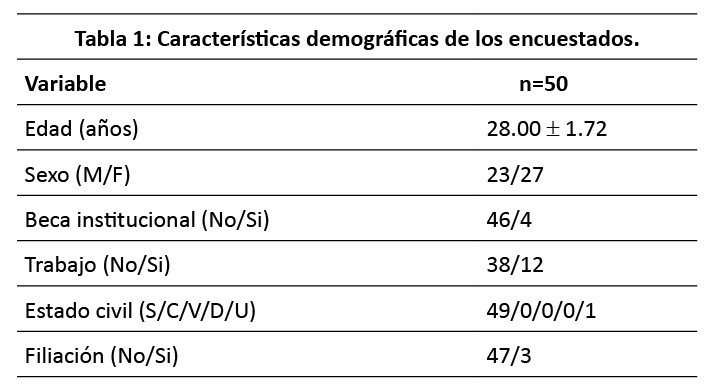
Se analizaron las respuestas de 50 residentes de Anestesiología, cuyo perfil demográfico predominante incluyó mujeres jóvenes con beca institucional, solteras y sin filiación. Las características demográficas se resumen en la (Tabla 1).
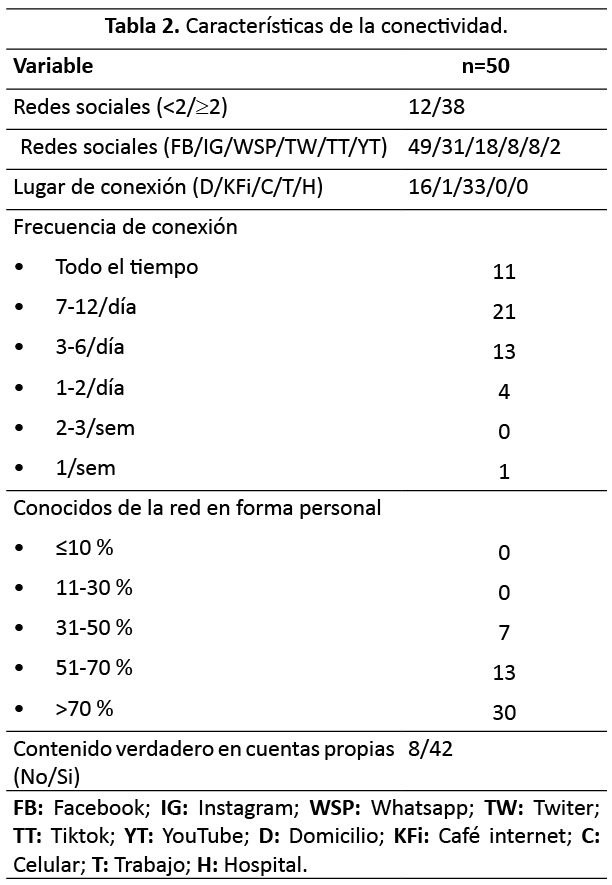
76 % de los residentes utilizan dos o más redes sociales, siendo Facebook la que se consolida como la de mayor demanda. Otra red social con gran demanda es la de Instagram, mientras que el siguiente escalafon lo ocupa el Whatsapp. La mayoría de los residentes se conectan en su celular, con una frecuencia de 7-12 veces por dia, proporcionando datos verdaderos en sus cuentas, e interaccionando personalmente con sus conocidos de la red. Las características de la conectividad se describen en la (Tabla 2).
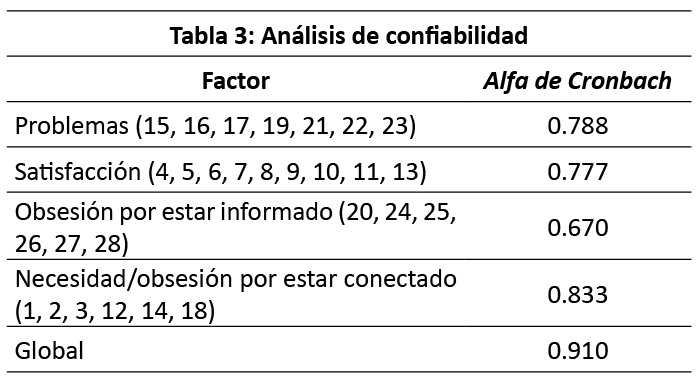
Al aplicar el instrumento, el análisis de confiabilidad se obtuvo mediante la aplicación del alfa de Cronbach encontrandose un valor global de 0,910 (Tabla 3), siendo el factor de necesidad/obsesión por estar conectado el de
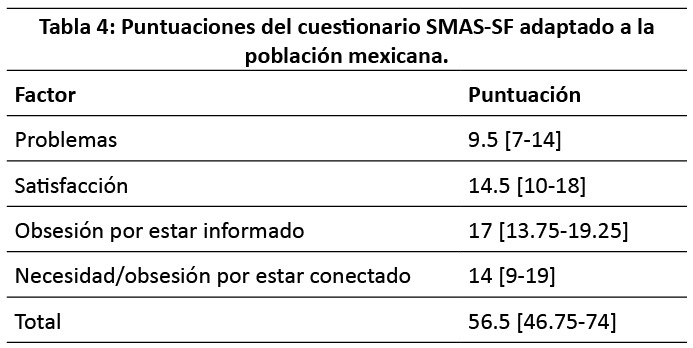
Examinando los factores por separado vemos que las mayores puntuaciones se encontraron en lo referente a la obsesión por estar informado. (Tabla 4)
Examinando las preguntas por separado vemos que las mayores puntuaciones se encontraron en lo referente al gusto por usar las redes sociales para mantenerse informados sobre lo que sucede y sobre lo que comparten los grupos de medios sociales, mientras que las menores puntuaciones se encontraron en cuanto al uso desmedido como para olvidarse de la familia, o que la vida pierda el sentido sin ellas. (Tabla 5)
Nuestro estudio revela hallazgos que demuestran la validez y la consistencia de los factores identificados, de manera equiparable a los resultados obtenidos por Sahin (2018) en su investigación con estudiantes en Turquía utilizando el instrumento SMAS-SF. (22) En consecuencia, hemos llegado a la conclusión de que este instrumento se presenta como una herramienta valiosa para evaluar tanto la presencia de adicciones como sus determinantes y ramificaciones.
Varios trabajos de investigación han abordado la problemática de la adicción a internet entre los médicos residentes mediante la prueba de adicción a internet, y en ellos se ha constatado una prevalencia de la adicción moderada a internet, lo que presenta similitudes
En concordancia con Grover y colaboradores quienes llevaron a cabo un estudio para examinar la conexión entre la adicción a Internet y el estado de salud mental entre 375 médicos residentes que trabajaban en un hospital de atención terciaria en la India. Utilizaron una serie de encuestas en línea que abarcaban varios aspectos, incluida la adicción a Internet, los síntomas depresivos, el estrés percibido, el agotamiento y los resultados relacionados con la atención médica. Descubrieron que aproximadamente el 54 % de los participantes mostraron signos de una adicción leve, mientras que el 8 % demostró una adicción moderada, sin observarse casos graves. Además, encontraron que estos resultados estaban asociados con una mayor gravedad de los síntomas depresivos, un mayor nivel de estrés percibido, mayor agotamiento, un aumento en el consumo de alcohol, mayor frecuencia en el consumo de pornografía, una proporción más alta de autoinformes de abuso físico/ verbal, y una menor percepción de empatía por parte de los pacientes (23) Consideramos que la similitud en los hallazgos pudiera deberse a que el entorno de los residentes pudiera ser similar, al tratarse de otro hospital de tercer nivel de atención.
Prakash llevó a cabo un estudio que examinó la adicción a Internet y la angustia psicológica en una muestra de 100 cirujanos internos y estudiantes de posgrado menores de 30 años. Utilizó la Prueba de Adicción a Internet y el Cuestionario de Salud General para recopilar datos. Los resultados revelaron que aproximadamente el 13 % de los participantes mostraron signos de una adicción moderada a Internet, la cual estuvo vinculada con residir en áreas urbanas y con la autorreporte de síntomas psiquiátricos adicionales (25). En discordancia con nuestro estudio podemos observar que los niveles de adicción son mucho menores que los reportados por nosotros, consideramos que esto puede deberse a que el estudio realizado por Prakash fue en una población distinta como es el caso de los cirujanos quienes a diferencia de los residentes de anestesiología tienen horarios de trabajo más intensivos y estructurado y durante su actividad asistencial muestran un mayor énfasis en la interacción cara a cara con los paciente, además de que asumimos que la naturaleza de las responsabilidades quirúrgicas, requieren un
El equipo de Mobasher realizó otro estudio que examinó la adicción a Internet, los hábitos de uso de Internet y la gravedad de los síntomas depresivos en una muestra de 300 médicos internos recién graduados de la Universidad de El Cairo, Egipto. Utilizaron la Prueba de Adicción a Internet, una Lista de Verificación de Aplicaciones de Internet y herramientas como el Inventario de Depresión de Beck-II y el Examen del Estado Actual-10 para evaluar los síntomas depresivos. Descubrieron que el 46 % de los participantes se consideraban usuarios normales de Internet, mientras que el 41.7 % y el 12 % informaron de una adicción leve y moderada, respectivamente. Además, observaron que una puntuación más alta en la Prueba de Adicción a Internet se correlacionaba con una mayor gravedad de los síntomas depresivos (24). A diferencia de nuestro estudio nosotros no analizamos síntomas depresivos, lo que pudo haber condicionado los resultados encontrados por Mobasher, en este sentido el uso excesivo de Internet puede llevar al aislamiento social y la falta de participación en actividades gratificantes fuera del entorno digital, lo que a su vez puede aumentar el riesgo de desarrollo de depresión. La pérdida de interés en actividades previamente placenteras y la disminución del contacto social pueden ser síntomas característicos tanto de la adicción a Internet como de la depresión, lo que sugiere una posible relación bidireccional entre ambas condiciones, bajo esta premisa si los residentes de anestesiología tienen niveles más elevados de adicción a internet pudiéramos inferir que tienen niveles más altos de depresión en comparación con los internos.
Como propuesta para futuras investigaciones, se sugiere explorar la adicción a las redes en otras especialidades médicas, así como su posible relación con variables como el género, el nivel académico y el entorno hospitalario. Sería interesante también examinar las divergentes percepciones sobre la adicción a las redes entre los médicos residentes y sus profesores de posgrado.
El desarrollo de nuestro estudio ha contribuido a establecer procesos formativos que incorporen medidas educativas destinadas a regular el uso de las redes sociales, con el objetivo de mejorar el bienestar psicológico de los médicos residentes (21).
Conclusión
Según los resultados de esta investigación, se puede inferir que los médicos residentes muestran una adicción notable a Internet. Predominan formas leves de adicción, mientras que los casos moderados son escasos y no se observan casos graves significativos.

Referencias
1. Benjamin GC. Ensuring health equity during the COVID-19 pandemic: the role of public health infrastructure. Rev Panam Salud Publica. 2020. [Internet] Consultado: 19 de marzo de 2021. Disponible en: https://doi.org/10.26633/ RPSP.2020.70
2. Toche N. ¿Con qué recursos humanos enfrenta México la pandemia de COVID-19? Medscape. 2020. [Internet] Consultado: 19 de marzo de 2021. Disponible en: https:// www.google.com/url?sa=t&rct=j&q=&esrc=s&source=we- b&cd=&ved=2ahUKEwjP9tS17b3vAhVQC6wKHVhxCpwQ- FjAAegQIAhAD&url=https%3A%2F%2Fespanol.medscape. com%2Fverarticulo%2F5905360&usg=AOvVaw3ssiDwiID- FMFWfFkeTGZGJ
3. Olmedo-Canchola VH, Bazán Miranda G, Torres Carrillo J, Ramírez-Tejeda M, Halabe-Cherem H, Hainze-Martin G. Los médicos residentes de la UNAM, piezas clave frente a la pandemia por COVID-19. Med Int Méx. 2020; 36 (6): 841- 851.
4. Norma Oficial Mexicana NOM-001-SSA3-2012, Educación en salud. Para la organización y funcionamiento de resi- dencias médicas [Internet] Consultado: 15 de marzo de 2021. Disponible en: https://www.google.com/url?sa=- t&rct=j&q=&esrc=s&source=web&cd=&ved=2ahUKEw- jRoYPT97PvAhVHKa0KHTHmCKgQFjAAegQIAhAD&url=ht- tps%3A%2F%2Fdof.gob.mx%2Fnota_detalle.php%3Fcodi- go%3D5284147%26fecha%3D04%2F01%2F2013&usg=AO- vVaw2ZvqUh3WZnlGOBfec7WIJK
5. Ley Federal del Trabajo artículo 353. [Internet] Consultado: 15 de marzo de 2021. Disponible en: https://www.google. com/url?sa=t&rct=j&q=&esrc=s&source=web&cd=&ve- d=2ahUKEwim7tbG-LPvAhUEKqwKHVSoDmgQFjABegQI- BBAD&url=http%3A%2F%2Fwww.abogadogeneral.unam.
35JleUyHeHRPxtctPqFw1T
6. UNAM. Legislación universitaria. [Internet] Consultado:
15 de marzo de 2021. Disponible en: https://www.goo- gle.com/url?sa=t&rct=j&q=&esrc=s&source=web&cd=&- ved=2ahUKEwiWtP3Q-bPvAhUIna0KHRz0BA8QFjAAeg- QIAhAD&url=https%3A%2F%2Fwww.defensoria.unam. mx%2Fweb%2Flegislacion&usg=AOvVaw1MNCY987zGl- D60ES-Oclo_
7. Herrera-Añazco P. Educación médica durante la pandemia del COVID -19: iniciativas mundiales para el pregrado, inter- nado y el residentado médico. Acta Med Peru. 2020; 37(2): 169-75
8. Balibrea JM, Badia JM, Rubio-Pérez I, Antona EM, Álva- rez-Peña E, García-Botella S, Álvarez-Gallego M, Martín Pé- rez E, Martínez-Cortijo S, Pascual Miguelañez I, Pérez-Díaz L, Ramos-Rodriguez JL, Espin-Basany E, Sánchez-Santos R, Soria-Aledo V, López-Barrachina R, Morales-Conde S. Ma- nejo quirúrgico de pacientes con infección por COVID-19. Recomendaciones de la Asociación Española de Cirujanos. Cir Esp. 2020; 98(5): 251–9.
9. Dabanch-Peña J. Cirugía en tiempos de COVID. Rev. Cir. 2020;72(5):381-3.
10. Viniegra VL. El desarrollo de aptitudes. En Refundar la edu- cación. Hacia otra subjetividad. 2012, pp. 194-249.
11. Pantoja PJ, Barrera MM, Isafran S. Instrumento para eva- luar la aptitud clínica en anestesiología. Rev Med IMSS 2003; 41 (1): 15-22.
12. Elizondo-Zapién RM, Pantoja-Palmeros M, Elizaldi-Lozano N, Benavides-Caballero T, ML Prieto-Duarte. Evaluación de la aptitud clínica en anestesiología para trasplante renal. Anestesia en México 2009; 21(2):93-7.
13. Degollado-Bardales L, Leyva-González FA, Viniegra-Veláz- quez L, Gonzaga-Juárez R, Zavala-Arenas JA. Competencia clínica de los residentes de anestesiología en pacientes que requieren atención médica en un hospital de especialida- des. Gac Méd Méx 2009; 145 (6): 481-9.
14. Sánchez FR, Durcudoy JM, Juárez CA, et al. Aptitud clínica en residentes de medicina del trabajo. Rev Med Inst Mex Seguro Soc 2009; 47(5):557-564.
15. Pérez JP, Aguilar EM, Viniegra LV. La aptitud para la inter- pretación de imágenes gamagráficas en residentes de me- dicina nuclear. RIC 2002; 54(1): 29-35.
16. Ochoa-Castro CE, Cobos-Aguilar H, Treviño Frutos RJ. Ap- titud clínica en la interpretación de electrocardiograma en médicos becarios mediante una intervención educative. Inv Educ Méd 2015; 4 (14): e2–e3
17. Arrieta-Pérez RT, Lona-Calixto B. Instrumento para medir aptitud clínica del médico familiar en cervicovaginitis. Rev Med Inst Mex Seguro Soc 2011; 49 (3): 307-309.
19. Norma Oficial Mexicana NOM-006-SSA3-2011, “Para el ejercicio de la anestesiología. [Internet] Consultado: 15 de marzo de 2021. Disponible en: http://www.dof.gob.mx/ nota_detalle.php?codigo=5240668&fecha=23/03/2012
20. Viniegra-Velázquez L. Algunas consideraciones compara- tivas entre los exámenes de opción múltiple tipo (una de cinco) y falso/verdadero/no sé. Rev Invest Clin 1979; 31: 413-420.
21. Pérez-PadillaJR,ViniegraVL.Métodoparacalcularladistri- bución de calificaciones esperadas por azar en un examen del tipo falso, verdadero y no sé. Rev Invest Clin 1989; 41: 575-579.
22. Zúñiga-González CG, Cárdenas-Aguilera P. Intrumentos de evaluación: ¿Qué piensan los estudiantes al terminar la es- colaridad obligatoria? Perspectiva Educacional. Formación de Profesores 2014; 53 (1): 57-72
23. Nolla-Domenjó M. Aprendizaje y prácticas clínicas. Educ Med 2019; 20(2): 100-4.
24. UANL. Treviño-Reyes R. La transformación del maestro a facilitador: el reto del siglo XXI. 2016. [Internet] Con- sultado: 26 de abril de 2021. Disponible en: https:// www.google.com/url?sa=t&rct=j&q=&esrc=s&sour- ce=web&cd=&ved=2ahUKEwjcroKWn5zwAhVqQzA- BHUZgCpcQFjAAegQIAxAD&url=http%3A%2F%2Fwww. web.facpya.uanl.mx%2Fvinculategica%2FRevistas%- 2FR2%2F3062-3082%2520%2520La%2520trans- formacion%2520del%2520maestro%2520al%- 2520facilitador%2C%2520El%2520reto%2520del%2520si- glo%2520XXI.pdf&usg=AOvVaw3qy_EY3EUS3hT0UJt3J8sZ
25. Nayen-Fernández E, Pereda-Torales L, Sabido-Siglher C, Blanco-Cornejo A, Soler-Huerta E, Márquez-Celedonio FG, Sabido-Siglher AS. Instrumento para medir aptitud clínica del interno de pregrado en atención domiciliaria del diabé- tico con complicaciones crónicas. Rev Med Inst Mex Seguro Soc 2009; 47 (5): 523-9.
Trastorno de Uso de Sustancias (tus) en los Anestesiólogos.
Anesthesiologist’s Substance Use and Abuse Disorder.
1Bernardette Casillas Sánchez. 1Medico Anestesióloga, Maestra en Psicoterapia. Comisión de salud Mental. FMCA AC.
Anestesia en México 2024;36(2):
Fecha de recepción abril 2024, fecha de revisión abril 2024, fecha de publicación mayo 2024. drabernardette@yahoo.com
” Trabajo Decente es Trabajo sin Riesgos” y trabajo sin riesgos es trabajo sin adicciones, pensando en el concepto de adicciones como “incremento del riesgo”. Juan Somavia, Director. Organización Mundial del Trabajo.
Resumen
El uso y abuso de sustancias psicotrópicas ha existido en el humano y en algunos animales desde tiempos inmemorables. En el médico, quizá por las peculiaridades de su profesión, que implica mucha competencia, retos académicos y habilidades especializadas, este problema también existe, según algunas fuentes con la misma frecuencia que en la población en general; sin embargo, en el anestesiólogo parece ser que la frecuencia se incrementa en relación con otros especialistas. Trataremos de desterrar los términos peyorativos para referirnos a los compañeros afectados con esta patología, y presentamos una revisión amplia de la génesis, sustancias involucradas más comúnmente, y manifestaciones clínicas de la enfermedad.
Palabras clave: Psicoestimulantes, narcóticos, drogas, trastorno de uso de sustancias.
Abstract
Psychotropic substances use and abuse has being around all over the world for ages, in both, animals and humans.
Physicians, maybe due to the particular requirements of the profession: academic challenges, competitivity and specialized skill, to mention some, are subjects to this problem too; some authors think that Substance Use and Abuse are as frequent in doctors as in the general population, but Anesthesiologists seem to exceed that number in comparison to other specialists. We here try to banish the term “drug addict” and similar in referring to this particular group of patients, by presenting a wide revision of the genesis, more frequently used substances and symptoms of this terrible ailment.
Keywords. Psychostimulants, narcotics, drugs, substance use disorder.
Introducción.
La vida, y la vida moderna en particular, plantea retos importantes de índole física y psicológica, y nadie está exento de ellos. Los médicos, por la naturaleza misma de su profesión, que implica el deber de obtener un gran caudal de conocimientos y destrezas para ser capaces de proporcionar cuidados de calidad a sus pacientes,
dificultad para tomar decisiones saludables, que presenta alta probabilidad de recaídas, y que raramente se cura, por lo cual necesitará de tratamiento crónico. Este tratamiento incluirá un abordaje multidisciplinario, que incluya el manejo de factores psicosociales, emocionales y espirituales, que pudieran haber influido en la manifestación de la patología (3).
Problema.
Es conocido que el trastorno por uso de sustancias (TUS) es un problema de salud pública mundial, con múltiples facetas: producción, tráfico, distribución, consumo dependencia, que causa gasto público por días de trabajo perdidos, atención a la salud y pérdida de vida de ciudadanos en edad laboral. Se conoce que el TUS se asocia a lesiones y a más de 60 enfermedades infecciosas (4). El consumo de psicotrópicos también favorece actividades criminales, asociadas a la compra de psicotrópicos en el mercado ilegal, sustracción de los mismos de las instituciones de salud o actos realizados bajo el influjo de la sustancia, lo que implica pérdidas económicas al paciente y su familia, inseguridad pública y pérdida de vidas. Esta pandemia afecta el desarrollo económico y social de los países, y se llega a asociar con diferentes manifestaciones de violencia.
El abuso y la adicción al alcohol, la nicotina y las drogas ilícitas y medicamentos recetados les cuestan a los estadounidenses más de $700 mil millones al año, ya que se incrementan los costos de atención médica, se genera mayor delincuencia y se pierde productividad. Cada año, las drogas ilícitas y recetadas y el alcohol provocan la muerte de más de 90,000 personas en ese país, mientras que el tabaco está vinculado a un estimado de 480,000 muertes por año (5).
Epidemiología.


Un estudio en Brasil (8) reveló que el 10 al 12 % de los mé- dicos padecen TUS. Esta prevalencia es mayor que la de la población en general para alcohol, narcóticos y tranquili- zantes. De estos médicos, el 10.9 % eran anestesiólogos. Estos especialistas tuvieron TUS relativo a narcóticos tres veces más que otros médicos. Aunque es difícil conocer las cifras reales en México, podemos pensar que se ase- mejan a éstas.
El registro de muertes causadas por el uso/abuso de alguna sustancia psicoactiva en nuestro país revela que murieron 2609 personas en 2019 por esta causa (9). De ellas, 2554 eran hombres, 120 mujeres y 18 no identificados. Las sustancias responsables: alcohol, tabaco, cocaína, disolventes volátiles, y opioides. La mayoría de las muertes ocurrieron en el estado de México (279) y en la
ciudad de México (182). Los estados donde se reportaron menos muertes por sobredosis fueron Yucatán, Coahuila, Sonora y Morelos.
La Organización Mundial de la Salud (OMS), proyectó que para el 2030 el principal motivo de muerte en el mundo serán los trastornos mentales (10).
En el informe Panorama de la Salud 2021 (Health at a Glance 2021) de la OCDE sustenta que el efecto de la pandemia en la salud mental ha sido mayúsculo; al impactar de manera severa los casos de ansiedad, misma que tuvo un doble aumento a los niveles observados antes de la crisis sanitaria, con datos disponibles demuestran esta problemática sobre todo en los países de México, Reino Unido y Estados Unidos; por lo que es necesario reforzar la resiliencia en los sistemas de salud y priorizar la promoción de la salud mental, toda vez que una mala salud mental afecta a millones de personas y genera costos económicos de más del 4 % del Producto Interno Bruto; hasta la fecha se sigue descuidando la atención a la salud mental, al ser insuficiente lo que se invierte a este rubro.
Etiología.
Según varios autores (11-13), la adicción es una enfermedad inducida por el estrés, que actúa sobre una predisposición genética que modifica las áreas de aprendizaje del cerebro medio y las áreas de emoción en la corteza frontal. Estos cambios producen pérdida de control, compulsión, búsqueda, y continuidad de uso a pesar de daño psicológico y físico (13) para el paciente y su familia. Se considera una enfermedad del cerebro porque este órgano se altera en su estructura y funcionamiento. Estos cambios pueden ser de larga duración, y conducir a comportamientos peligrosos. Algunos estudios han encontrado que existen influencias genéticas para desarrollar alcoholismo tanto en hombres como en mujeres (11) y se avanza en el conocimiento acerca de los problemas que predisponen a esta situación, tales como la ansiedad y la impulsividad. Aunque el abuso del alcohol frecuentemente se encuentra unido al de otras sustancias y a problemas psiquiátricos, los estudios recientes han mostrado, que, con excepción del tabaquismo, la heredabilidad de este problema es específica (12). El estudio de la neurobiología de las adicciones ha identificado vías neurales mediante las cuales una variación genética podría influenciar la vulnerabilidad de un sujeto, y ya se han identificado algunas variantes funcionales de estos genes. Estos avances en la genética debieran conducir al desarrollo de nuevas terapias, usando un diagnóstico molecular (14).
Es entonces importante conocer que el consumo importante de alcohol y otras sustancias (especialmente cocaína y tranquilizantes) se asocia con ansiedad, ataques de pánico, depresión y otros problemas de la esfera psicológica y emocional (16). El pánico puede llevar a consumir alcohol o sedantes, y otras sustancias, especialmente cocaína, y se puede pensar que exista una relación biológica entre el receptor de benzodiacepinas y el sistema noradrenérgico. Aunque apenas se ha iniciado a estudio del efecto del tratamiento del pánico en personas dependientes del abuso de sustancias, se han implementado algunas guías para reconocer y tratar a estos pacientes (16).
En México, diferentes instancias de salud han enfocado sus esfuerzos a conocer la magnitud del problema y a tratar de contenerlo (17).
Existe una encuesta que realizó el Dr. Marco Antonio Morales Domínguez, Comité de Riesgos Profesionales
de la entonces Federación Mexicana de Anestesiología (2009) y que no se publicó, en que se encuentra que el 47 % de los encuestados manifestaron ansiedad y el 26 % depresión. Asimismo, el 12 % de ellos buscaron a un psiquiatra, el 17 % a un psicólogo, y el13 % recibió tratamiento: el 10% antidepresivos, el 14% ansiolíticos, y el 14% “otros”. El 59% eran fumadores, el 39 % consumía alcohol, de los cuales el 2 % lo hacía cotidianamente; el 4.27 % admitió haberse presentado alcoholizado a laborar. 6.41 % admitió el consumo de sustancias psicoactivas, que originaba problemas personales, familiares y laborales. El 5.3 % se retiró del ámbito laboral, aunque fuese por un tiempo como consecuencia de un trastorno psicológico. Este trabajo presenta datos muy interesantes, y sería apropiado repetir el cuestionario para conocer el cambio epidemiológico, si es que lo hay.
Clínica.
No es la meta de este artículo de revisión el hacer una descripción detallada de los signos y síntomas de la enfermedad, y presentaremos los más notables y comunes, los datos que algunas personas cercanas al enfermo pueden notar, aunque sea difícil comunicarlo a las autoridades pertinentes por las razones sociales y laborales anotadas arriba.
Las manifestaciones de esta enfermedad pueden incluir, además de la necesidad de consumir una sustancia o desarrollar una actividad de riesgo: conductas socialmente y profesionalmente inaceptables, y la historia natural puede conducir a la muerte. Los signos incluyen (18):
i. Frecuentes cambios de humor. ii. Irritabilidad.
iii. Enojo.
iv. Aislamiento.
v. Pérdida de peso.
vi. Proponerse para doble turno.
vii. Prefiere trabajar solo.
viii. Acudir al hospital durante su descanso.
ix. Rehúsa lo releven del trabajo.
x. Múltiples ausencias para ir al baño.
xi. Solicita más psicotrópicos que sus compañeros para casos similares, sobre todo antes de días de descanso.
xii. Reporte de sustracción de psicotrópicos en su entorno.
Diagnóstico.
Tampoco es el objetivo de este trabajo detallar los métodos diagnósticos de esta enfermedad. Sn embargo, incluimos algunos de los criterios publicados por el DSM
IV TR, el Manual de los trastornos mentales19. Se considera la adicción como un patrón desadaptativo de consumo de la sustancia, que conlleva un deterioro o malestar clínicamente significativo, expresado por tres (o más) de los ítems siguientes en algún momento de un período continuado de 12 meses:
1. Tolerancia, definida por cualquiera de los siguientes ítems: a. una necesidad de cantidades marcadamente crecientes de la sustancia para conseguir la intoxicación o el efecto deseado b. el efecto de las mismas cantidades de sustancia disminuye claramente con su consumo continuado.
2. Abstinencia, definida por cualquiera de los siguientes ítems: a. el síndrome de abstinencia característico para la sustancia (criterio A y B de los criterios diagnósticos para la abstinencia de sustancias específicas) b. se toma la misma sustancia (o una muy parecida) para aliviar o evitar los síntomas de abstinencia.
3. La sustancia se toma con frecuencia en cantidades mayores o durante un período más largo de lo que inicialmente se pretendía.
4. Existe un deseo persistente o esfuerzos infructuosos de controlar o interrumpir el consumo de la sustancia.
5. Se emplea mucho tiempo en actividades relacionadas con la obtención de la sustancia (por ejemplo, visitar a varios médicos o desplazarse largas distancias), en el consumo de la sustancia (por ejemplo, una dosis tras otra), o en la recuperación de los efectos de la
sustancia.
6. Reducción de importantes actividades sociales,
laborales o recreativas debido al consumo de la
sustancia.
7. Se continúa tomando la sustancia a pesar de tener
conciencia de problemas psicológicos o físicos recidivantes o persistentes, que parecen causados o exacerbados por el consumo de la sustancia (por ejemplo, consumo de cocaína a pesar de saber que provoca depresión, o continuada ingesta de alcohol a pesar de que empeora una úlcera) (19).
Marco legal.
En México, el 16 de mayo de 2022 se publicó en el Diario Oficial de la Federación (DOF), el Decreto por el que se reforman, adicionan y derogan diversas disposiciones de la Ley General de Salud (20), en materia de Salud Mental y Adicciones, estableciéndose lo siguiente en el artículo 72: “La salud mental la prevención de las adicciones tendrán carácter prioritario dentro de las políticas de salud y deberán brindarse conforme a lo establecido en la Constitución y en los tratados internacionales en materia
“Toda persona tiene derecho a gozar del más alto nivel posible de salud mental, sin discriminación por motivos de origen étnico o nacional, el color de piel, la cultura, el sexo, el género, la edad, las discapacidades, la condición social, económica, de salud o jurídica, la religión, la apariencia física, las características genéticas, la situación migratoria, el embarazo, la lengua las opiniones, las preferencias sexuales, la identidad, la expresión de género, la filiación política, el estado civil, el idioma, los antecedentes penales o cualquier otra que atente contra la dignidad humana y tenga por objeto anular o menoscabar los derechos y libertades de las personas”.
“Para los efectos de esta Ley, se entiende por salud mental un estado de bienestar físico, mental, emocional y social determinado por la interacción del individuo con la sociedad y vinculado al ejercicio pleno de los derechos humanos: y por adicción a la enfermedad física y psico- emocional que crea una dependencia o necesidad hacia una sustancia, actividad o relación”.
“Dicha iniciativa tiene como objetivo que la Secretaria de Salud, instituciones de salud y las entidades federativas capaciten continuamente al personal médico, paramédico y administrativo en materia de primeros auxilios psicológicos, intervención de crisis, prevención, detección oportuna y atención de trastornos mentales del comportamiento”20.
El 10 de octubre de 2022, durante la conmemoración del Día Mundial de la Salud, en la que asistió́ la Organización Mundial de la Salud (OMS/OPS), en República Dominicana, la Asesora Regional de Salud Mental y Uso de Sustancias para Centroamérica, Caribe Latino y México, informó que los trastornos de depresión y los trastornos de ansiedad suponen la segunda y cuarta causa principal de carga de enfermedad (medida en años de vida con discapacidad) respectivamente21.
En México, como Estado miembro de tratados internacionales en los que se declara la protección de salud física, mental y social, tenemos la obligación de garantizar y hacer efectiva la protección al derecho de la salud, en el caso particular, respecto del tratamiento de las enfermedades mentales y la rehabilitación en materia de adicciones, asegurando que todos los sectores de la sociedad se involucren para la consecución de los fines y materializar acciones legislativas y ejecutivas en los 3 niveles de gobierno. Durante la 624 sesión de la Comisión de Estupefacientes, en marzo de 2019, los Estados
Anotamos más arriba los factores de riesgo para el TUS, y, aunque e estudio de estos factores abarcaría mucho más del enfoque de este estudio, mencionaremos algunos factores que, en la adolescencia, durante la etapa de individuación del individuo pudieran facilitar este hábito (23): La ausencia de espacios sociales debidamente estructurados para permitir la inserción social y el desarrollo positivo de la identidad se produce cuando:
• Existe una estructura familiar monoparental o extendida que puede funcionar en forma conflictiva y no brindar un soporte estable a los cambios propios del proceso adolescente.
• Los desafíos que se ofrecen al sector adolescente son desarticulados, consumistas, efímeros, etc.
• Las oportunidades de participación más accesibles están construidas por culturas de trasgresión y evasión.
• Las oportunidades de gratificación y opciones de
relevancia social constructiva son restringidas. Asimismo, se considera que el estado de salud psicológica y físico de un sujeto, más que ser producto únicamente de factores biológicos, se encuentra determinado en gran medida por las condiciones de la realidad social que lo rodean. Es probable que la familia, al ser el nicho principal del mayor número de relaciones de carácter afectivo y el principal contexto de aprendizaje de un individuo, sea la que favorezca el comportamiento de una persona 23. Algunos autores (23) consideran como factores protectores a las circunstancias, características, condiciones y atributos que facilitan el logro de la salud integral del adolescente y sus relaciones con la calidad de vida y el desarrollo de éstos como individuos y como grupo. Alguno de estos factores puede estar en las personas mismas: Son las características, logros o atributos presentes, antes, durante y después de la adolescencia; otros pueden estar presentes y operar en el seno familiar, unos más aparecen como características del grupo o de las comunidades y sus organizaciones. La existencia de factores aislados puede no tener un efecto determinante, en comparación con una multitud de elementos complementarios atribuidos
en las diversas instancias señaladas. La coparticipación de esas instancias refuerza los factores.
Las personas, familias y sociedades deben estar conscientes de las ventajas de los factores protectores, valorarlos, asumir la responsabilidad de su incorporación, refuerzo y conservación. Deben reconocerse los efectos positivos de estos factores no solo durante el período de la adolescencia sino a lo largo de las etapas del ciclo vital y a lo largo de generaciones. · Así como los factores de riesgo no son el resultado del azar ni surgen espontáneamente, lo mismo ocurre con los factores protectores; algunos de éstos serían (23):
1. Auto estima, auto concepto, auto eficacia adecuada, y sentido de pertenencia e identidad grupales
2. Perspectivas de construir proyectos de vida viables. 3. Escalas de valores congruentes con un desarrollo espiritual adecuado, en las que el amor, la verdad, la libertad, el respeto, la responsabilidad, la religiosidad, la moral y otros valores, se practiquen
debidamente y en los ambientes apropiados.
4. Estructuras y dinámica familiares congruentes con
los procesos básicos y las funciones de la familia.
5. Familias y sociedades dispuestas a trabajar por una
niñez, adolescencia y juventud saludables.
6. Micro ambientes familiares, escolares, laborales, deportivos y recreativos que sean saludables y propicios para el desarrollo de la gente joven de
ambos sexos.
7. Niveles crecientes de auto cuidado y de
responsabilidad en los dos sexos en relación con su
salud reproductiva.
8. Ayuda mutua y existencia y uso adecuado de redes
sociales de apoyo.
9. Promoción de investigaciones que permitan
identificar las necesidades y mecanismos capaces de disminuir los problemas emergentes.
Sustancias más comunes de uso/abuso.
Alcohol (CIE 10: F.10). Quizá la sustancia psicoactiva más utilizada de manera frecuente por la humanidad (y algunos animales (24)), y en la mayoría de los países del mundo es legal. Son incontables los textos antiguos que hacen referencia al consumo de esta sustancia, incluyendo la Biblia. En muchas sociedades, es aceptada y aun deseable ofrecer y consumir una bebida alcohólica. La pregunta es: ¿porqué en algunas personas aparece el hábito de consumir alcohol de manera importante y frecuente, hasta cotidiana, que les puede llevar a la enfermedad y la muerte?
En la encuesta sobre calidad de vida y desgaste profesional en médicos de México, del año 2019 (25) se reporta que casi la mitad de los médicos informó sufrir de desgaste profesional, y un 17 % reconoce estar deprimido. Estos resultados son más frecuentes entre los médicos jóvenes y los que trabajan jornadas largas. Las mujeres y los jóvenes suelen estar más deprimidos clínicamente. La economía y el trabajo son los factores que más influyen en la depresión. El 17 % de los médicos encuestados reconoce beber alcohol para aliviar sus molestias, el 5 % ente 5 y 10 tragos por semana, y el 3 % más de 10 (25).
El alcohol es una sustancia con propiedades adictivas, de alta aceptación social, legal en muchos lugares, cuyo uso indiscriminado puede producir enfermedad y muerte, El gremio médico parece especialmente proclive a este hábito (25). Entre los universitarios se encontró que hay una tendencia a iniciar el consumo de alcohol a muy temprana edad, y se asocia a situaciones emocionales positivas o negativas (26). Su uso tiene relación con una baja tolerancia a la frustración y para evitar situaciones que causan desagrado. Entre los estudiantes no se ve el consumo de esta sustancia como un factor de riesgo, y los jóvenes de sexo masculino presentaron mayor consumo episódico excesivo. Existe un factor protector circunstancial, que es la falta de un trabajo remunerado y la consecuente carencia de dinero extra26 para comprar alcohol.
Se sabe entonces que el consumo excesivo de alcohol es una condición crónica con un alto riesgo de recaídas. En los programas de tratamiento que intentan lograr la abstinencia entre personas con este problema, se encuentra que el 80% reportan recaídas en un período de 6 meses27, y los resultados son inestables en un tiempo más prolongado. Existe un inventario sobre consumo de alcohol (ISCA= Inventario situacional de consumo de alcohol) desarrollado en el CONACYT que pudiera ser de suma utilidad en la identificación de las situaciones de alto riesgo para una recaída y planear un tratamiento (28). El 8.2 % de la población general en México con más de 15 años padece un trastorno por el consumo de alcohol,
Analgésicos opioides (CIE 10: F.11). En un afán de mitigar el dolor somático, el ser humano -y algunos animales: (National Geographic en español)- han recurrido al uso de algunas plantas con propiedades analgésicas, como la amapola, marihuana, hashish, coca, hongos y otras. El reporte más antiguo acerca del opio se encuentra en un registro que data de hace cerca de 5000 años, donde los sumerios la describen en un ideograma como ”la planta de la alegría” (30,31). Cerca de Tebas existían plantíos de amapola, lo cual indica que se utilizaba (32). Los griegos antiguos conocían las propiedades hipnóticas y analgésicas del opio, y ellos son los que establecen el nombre “ophium” (jugo) para denominarlo (31,32). Hipócrates recomendaba el opio como purgante (?), narcótico y para curar la leucorrea (33). Entre los romanos, Celso lo recomendó como analgésico (34), y posteriormente Galeno, en el S II dC fue el primero que percibió y describió los riesgos del uso exagerado, quizá basándose en el caso del emperador Antonino, quien probablemente fue dependiente de la sustancia (34). Tras la caída del imperio romano, y el florecer de la civilización islámica, entre los siglos IX y XVI, se retoman los estudios sobre las drogas realizados por los griegos y los romanos. Los árabes pasan a denominar al opio “af-yun”, lo reconocen como el más poderoso de los analgésicos y lo indican para el tratamiento de diarreas, otalgias, artralgias y dolencias oculares. administrándolo tanto por vía oral como por vía rectal33,35. En el siglo IX surgió, entre los médicos árabes, una mezcla de opio, mandrágora, cicuta y hiosciano, destinada a producir anestesia por inhalación para procedimientos quirúrgicos (30). Fueron los árabes quienes, durante su época de oro, dominando el comercio del Océano Índico introdujeron el opio en la India y posteriormente en China, donde le dieron el nombre de “o-fu-yung” y fue usado durante casi un milenio básicamente para el control de la diarrea30. En la época del Renacimiento, Paracelso (1493-1541), médico suizo, fue quien reincorporó el opio en Europa occidental, denominándolo “piedra de la inmortalidad”32. En 1700, John Jones, un médico londinense, publicó
A principio del siglo XIX, en 1808, William Collen, publica el Tratado sobre la Materia Medica, en el que intenta describir el mecanismo de acción del opio, proponiendo que es causado por la inhibición de mensajes de los nervios hacia el encéfalo y viceversa, causando, en consecuencia, analgesia. También observó que, aunque el opio fuera un sedante, en algunos individuos podría producir un efecto excitante inicial36. Por otro lado, años más tarde, en 1816, Friedrich Sertürner, un farmacéutico alemán, aísla el principio activo del opio al que llama Morphium, recordando a Morfeo, dios del sueño (30). Tiempo después el químico Gay Lussac, francés, acuña el término Morfina (37), que persiste hasta hoy.
La morfina se encontró libremente de manera comercial en Europa y USA durante algún tiempo, siendo expendida en farmacias y hasta en tiendas de abarrotes. Se trataba principalmente de una tintura compuesta del 10% de opio en polvo (papaver somníferum Linnaeus) disuelta en etanol. Se le denominó Laudano, y contiene varios alcaloides del opio, como la morfina y la codeína. Se usó como analgésico y antitusígeno. Hasta principios del siglo XX, el láudano se vendía sin receta y formaba parte de muchos medicamentos patentados. Hoy en día, el láudano es reconocido como adictivo y está estrictamente regulado y controlado como tal en la mayor parte del mundo. La Ley de Sustancias Controladas de los Estados Unidos, por ejemplo, lo incluye en el Anexo II, la segunda categoría más estricta. En la literatura y en el cine abundan los ejemplos del uso del Laudano y otros opioides, y en The Lancet apareció un relato claro de caso de abuso de opio (38). Alrededor de 1854 se empleó la morfina oral y/o subcutánea como analgésico en combatientes heridos en la guerra civil de USA, y se empezaron a reportar casos de dependencia física a la sustancia (39).
En el paso del siglo XIX al siglo XX, debe mencionarse la “paradoja de la heroína”. Se proclamó que esta sustancia podía sustituir a la morfina, con ventajas, ya que aliviaba los síntomas del síndrome de abstinencia causada por la morfina y, por lo tanto, no debía producir los inconvenientes a ella atribuidos. Esta creencia persistió durante años, hasta que se comprobó que es uno de los alcaloides que más rápidamente promueve la dependencia32. En 1939 surgió la meperidina, el primer opioide completamente sintético (40).
En 1956 se lanzó la dextromoramida, en 1957 la fenoperidina, en 1960 el fentanilo, y posteriormente
Opioides semisintéticos. Heroína. O diacetil morfina. Fue sintetizada por Charles Alder Wright en 1874, en un intento de encontrar una sustancia que aliviara los síntomas de abstinencia de la morfina, y resultó ser más adictiva que ésta (43). Hoy en día, constituye una de las sustancias más adictivas. La combinación de heroína y cocaína, llamada speed ó speedball es una droga de consumo popular en algunos países. Actualmente la heroína está clasificada como una sustancia sin valor terapéutico, con alto potencial adictivo.
Fentanil (44). Es un opioide sintético con potentes propiedades analgésicas y anestésicas, y se asocia a una crisis de abuso en algunos países, especialmente USA. Hasta hace poco, la amenaza se percibía lejana, que azotaba sólo la frontera norte del país y a USA. La falta de datos oficiales sobre el uso/abuso de esta sustancia (que sabemos es aproximadamente 100 veces más potente que la morfina, dependiendo de la vía de administración45)
hace difícil dimensionar el problema. Sin embargo, en 2023 se publicó un estudio que el fentanilo ha llegado cuando menos a la capital del país y sus alrededores (45). Es una sustancia relativamente fácil de sintetizar y manufacturar, y menos difícil de traficar que otras, puesto que requiere menos espacio para su transporte. La mayoría de las muertes causadas por sobredosis de esta sustancia resultan de ingestión, como sustituto de heroína, o por medio de cocaína o metanfetaminas adulteradas (cortadas) con esta sustancia. El TUS de fentanilo entre anestesiólogos es, mayoritariamente, con conocimiento de sus efectos. Las fórmulas adulteradas que contienen fentanilo más cocaína, heroína u otros psicoestimulantes presentan más riesgo de intoxicación y muerte44. Sus propiedades farmacológicas únicas han contribuido a su uso extendido, al ser excelente analgésico, potente y de gran liposolbilidad, lo que lo hace cruzar rápidamente la barrera hematoencefálica, aunque su acción es mucho más corta que la morfina. La gran capacidad que presenta de producir depresión respiratoria es conocida. Su gran afinidad por los receptores Mu le confieren alta potencia y efectos placenteros, que son responsables de su alta potencialidad de producir dependencia física y recaídas (44). Por eso el fentanilo es responsable de la gran cantidad de casos de sobredosis y muerte por TUS. Durante la pandemia de COVID 19 se incrementaron los casos de TUS a pesar de las medidas de aislamiento poblacional (46). El fentanilo, y sus análogos, como los nuevos opioides potentes pertenecientes a la familia de nitrazeno (brorfina, isotonitazene, metonitazene y/o N-piperidinil etonitazene) son de las sustancias que en números crecientes se detectan en pacientes que llegan con sobredosis de narcóticos ilícitos a los departamentos médicos de urgencias en USA (47).
Otras sustancias psicotrópicas:
Cannabis (CIE 10: F.12). Se ha hablado mucho del cáñamo y sus derivados (marihuana, grifa,kif, hachís, etc) que tiene una historia tan antigua como 8000 años AC, pues desde entonces se cultivaba para elaborar tejidos. El emperador Shen-Nung, en un libro escrito alrededor del 2737 AC dice que, tomada en exceso, la sustancia “tiende a mostrar monstruos, si se usa durante mucho tiempo puede comunicar con los espíritus y aligerar el cuerpo”. Se prescribe ahí para la “debilidad femenina, gota, reuma, estreñimiento, malaria, gripe y desmayos (48). La planta llegó a México con los conquistadores, quienes la utilizaban para fabricar cuerdas y otros enseres tejidos. Con el tiempo se aumentó su uso con fines de trance, junto con otras sustancias (peyote, ololiuqui, pipinzinzintles o “niños
Existen cerca de 193 millones de personas que usan cannabis en el mundo, y aunque la carga individual y de salud pública producida por ésta es menor la producida por otras sustancias, la mayoría de las personas que buscan tratamiento para un TUS están afectados por ella (51). Existen varios tipos de psicoterapia que pueden reducir sustancialmente el uso y por ende los problemas asociados a ella, aunque la abstinencia duradera no es un resultado frecuente (51). Las sensaciones de recompensa y refuerzo positivos del D-9-tetrahidrocanabinol son mediados por el receptor CB1 canabinoide, que se ha demostrado que media también la dependencia de la sustancia y las manifestaciones de abstinencia al cesar su administración, un fenómeno validado en varias especies animales (52), y que contradice la creencia anterior de que la mariguana causa dependencia psíquica y no física (53). El inicio temprano en el uso, así como el uso continuado durante la adolescencia son factores de riesgo para el abuso de esta sustancia y otros psicotrópicos, favoreciendo la habituación y dependencia, así como deterioro de la salud mental, bajos logros académicos, conducta sexual de riesgo y actividades criminales. Uno de cada diez personas que han consumido mariguana alguna vez se convertirán en dependientes, y el riesgo aumenta proporcionalmente a la frecuencia de uso (54). A pesar de que tradicionalmente se ha pensado que la mariguana produce paz y tranquilidad en quien la usa, estudios recientes la han asociado más frecuentemente a episodios violentos, especialmente en personas con trastornos mentales, como esquizofrenia (55). Asimismo, se comprueba que el uso de esta sustancia facilita el uso de otros psicotrópicos. Comparada con alcohol, la Academia Nacional de Medicina en USA encontró en 2017 que el uso de cannabis muy seguramente aumenta el riesgo de desarrollar psicosis, directamente en proporción a la frecuencia de uso, y también que el uso continuado de la sustancia puede producir Trastorno de ansiedad social
(54). Es importante establecer que, con la legalización de la mariguana en algunas regiones, y su fabricación y venta reguladas, el consumidor accede ahora a fórmulas más potentes, 20 a 25 % de tetrahidrocanabinol (THC), en contraste a 2 % que contenía la mariguana popular en la década de los 70 ́s.
Sedantes, hipnóticos, ansiolíticos (CIE 10: F.13). Los sedantes e hipnóticos, especialmente las benzodiacepinas se utilizan en varias indicaciones, especialmente para combatir la ansiedad, insomnio, epilepsia y otras patologías. Su uso continuado, sobre todo en combinación con alcohol u otras sustancias, puede producir habituación, dependencia y síndrome de abstinencia si se descontinúan súbitamente. Un sedante baja el estado de ánimo alterado y calma a la persona despierta, un hipnótico produce somnolencia y promueve el sueño. Los sedantes no benzodiacepínicos producen, dependiendo de la dosis: tranquilidad, sueño, inconciencia, coma, anestesia quirúrgica, y finalmente depresión respiratoria y cardiovascular, que pueden ser mortales. Estos efectos provienen de la depresión el Sistema Nervioso Central (SNC), y los producen también un sinnúmero de otros agentes: anestésicos generales, y alcohol. A bajas dosis los sedantes pueden producir torpeza motriz, que incluye hablar balbuceante.
Los efectos de los benzodiacepínicos se parecen a los de los sedantes, excepto que no producen anestesia quirúrgica, coma o muerte, aún a grandes dosis, excepto cuando se combinan con otros agentes que puedan producir depresión respiratoria. La sedación es también efecto secundario de otros medicamentos, como los antihistamínicos y los neurolépticos. Efectos secundarios de estas sustancias incluyen: problemas de memoria, dependencia física y/o posibilidad de abuso. Su efecto puede revertirse con el uso de flumazenil, que no revierte el efecto de otros sedantes (56). Estos medicamentos se introdujeron en la práctica clínica en la década de los 60 ́s, y sustituyeron rápidamete a los barbituratos. Inicialmente se pensó que eran la panacea, pero los efectos indeseables se hicieron presentes, especialmente con la asociación de otras sustancias. El grupo de edad en mayor riesgo para el abuso de estas sustancias parece ser de adultos jóvenes, entre 25 y 35 años (57).
Un estudio reportó que los adultos jóvenes que usan sedantes/hipnóticos sin prescripción son más proclives a usar también tabaco, abusar del alcohol, cocaína, éxtasis, estimulantes y/o analgésicos opioides, en una frecuencia de hasta el 66 % (57).
Sustancias estimulantes:
Cocaína (CIE 10: F.14). Es uno de los estimulantes de origen
En 1884, Freud publicó un artículo titulado “Über Coca” (Sobre la Coca) (60), en el cual promovía los “beneficios” de la cocaína, llamándola una sustancia “mágica”; sin embargo, no era un observador objetivo. Consumía cocaína regularmente, la prescribía a su novia y a su mejor amigo y la recomendaba para uso general. Aunque observó que la cocaína había conducido a la “decadencia física y moral”, Freud continuó promoviendo la cocaína entre sus amigos cercanos, uno de los cuales terminó sufriendo de alucinaciones paranoicas con “serpientes blancas que se arrastraban por su piel” (60). También creía que, “Para los humanos la dosis tóxica (de cocaína) es muy alta, y no parece haber una dosis mortal”. Al contrario de esta creencia, uno de los pacientes de Freud murió por una sobredosis que él le prescribió.
En 1886, la droga logró mayor popularidad cuando John Pemberton incluyó las hojas de coca como ingrediente en su nuevo refresco: la Coca-Cola. Los efectos eufóricos y vigorizantes sobre el consumidor ayudaron a elevar la popularidad de la Coca-Cola a comienzos de siglo (61- 63). A partir de la década de 1850 hasta principios de 1900, personas de todas las clases sociales comúnmente usaban elixires con cocaína y opio (pociones mágicas o médicas), tónicos y vinos. Celebridades que promovieron los efectos “milagrosos” de los tónicos y elixires de cocaína, incluyeron al inventor Thomas Edison y la actriz Sarah Bernhardt. En esa época, la droga llegó a ser popular en la industria del cine mudo y los mensajes a favor de la cocaína que salían de Hollywood influenciaron a millones de personas. El consumo de cocaína aumentó en la sociedad y los peligros de la droga poco a poco se volvieron más evidentes. La presión pública obligó a que en 1903 la compañía Coca-Cola eliminara las hojas de coca de su refresco. En 1905, se volvió popular “esnifar”
(inhalar por la nariz) cocaína y en menos de cinco años, los hospitales y médicos comenzaron a informar en su literatura, de casos de daño nasal causados por el uso de esta droga. En 1912, el gobierno de los Estados Unidos reportó cinco mil muertes relacionadas con la cocaína en un año (61-64); y para 1922 la droga fue prohibida oficialmente. En la década de los 70, la cocaína surgió como la nueva droga de moda para los artistas y hombres de negocios. Parecía la compañera perfecta para un viaje por el carril social de alta velocidad. Suministraba “energía” y ayudaba a la gente a permanecer “alerta”. En algunas universidades norteamericanas, el porcentaje de estudiantes que habían experimentado con cocaína se incrementó diez veces entre 1970 y 1980 (61-64).
Tradicionalmente, era una droga de hombres ricos, debido al alto costo para mantener el hábito de cocaína. A finales de los 80, la cocaína se popularizó. Para entonces, tenía la reputación en Norteamérica de ser la droga más adictiva y peligrosa, ligada a la pobreza, el crimen y la muerte. Hacia 2008, la cocaína se había convertido en la segunda droga ilegal más traficada en el mundo (65,66).
Estimulantes-otros- (CIE 10: F.15).
Las sustancias estimulantes tienen el efecto de excitar el SNC y otros órganos y sistemas. Aumentan el estado de alerta y elevan la presión arterial, el pulso y la temperatura. Producen un estado de euforia e hiperactividad. Entre estas sustancias se encuentran la cocaína (descrita arriba), el crak o “piedra”, las anfetaminas, y otras sustancias con efectos moderados, como la nicotina y la cafeína (67). Las anfetaminas fueron utilizadas por el ejército alemán para mantener a sus tropas estimuladas, aunque los soldados ingleses, norteamericanos y japoneses también recibieron de forma rutinaria sustancias para combatir el sueño, estimular su valor y reforzar su resistencia y agresividad. El crack o piedra es una variante de la cocaína que se caracteriza por tener efectos inmediatos y potencialmente mortales. Se suele vender con aspecto de piedra compuesta por cristales minúsculos de cualquier color. Puede consumirse de manea inhalada, calentándolo o fumándolo con una pipeta u objeto similar. Su nombre se debe al crujido que emite cuando se calienta. Se produce al mezclar cocaína con agua y amoniaco o bicarbonato de sodio. Esta fórmula particular tiene efectos muy rápidos, produciendo gran euforia (“subida”) a los pocos segundos del consumo, lo que dura muy poco, pues a los 5-15 minutos se desvanece el efecto, causando malestar y agotamiento (“bajada”) que incitan a volver a consumir. Al estimularse la producción de dopamina, o al semejar la sustancia la función de la dopamina, se estimulan los centros cerebrales del placer.
Los síntomas habituales de este trastorno son (67,68):
• Sensación de euforia
• Ataques de pánico
• Insomnio
• Alucinaciones
• Grandiosidad, paranoia.
• Pérdida de apetito.
• Hipertensión, taquicardia, arritmias. • Convulsiones
• Brotes psicóticos
• Accidentes cardiovasculares
• Cambios muy frecuentes de humor.
El abuso de esta sustancia lleva al paciente a conductas que pueden llegar a lo ilegal, perder las relaciones familiares y el trabajo. El final más trágico es que el paciente pierda la vida.
Anfetaminas. Fueron descubiertas hace más de 100 años. Pasaron de ser sustancias
libremente disponibles, a altamente restringidas. En la actualidad su uso terapéutico se limita al tratamiento de la hiperactividad y la narcolepsia (69). La acción estimulante al Sistema Nervioso Central que tiene la d-anfetamina resultan primeramente de la capacidad que tiene para facilitar la liberación de dopamina recién sintetizada a partir del cerebro frontal. Diversos experimentos revelan que las acciones estimulantes del sistema locomotor de dosis pequeñas de la sustancia dependen de la estimulación de neuronas dopaminérgicas mesolímbicas, mientras que el comportamiento estereotipado que produce depende de la acción estimulante sobre las neuronas dopaminérgicas nigro-estriadas. Las acciones centrales parecen depender de interacciones con neuronas dependientes de dopamina y de la dinámica alterada de otros neurotransmisores70. Aunque las anfetaminas están clasificadas como estimulantes, su acción farmacológica parece ser diferente a otros estimulantes, como la cocaína (71,72).
Ketamina.
Derivada de la fenilciclidina, es un antagonista no competitivo en el receptor N-Metil-D-Aspartato (NMDA), se conoce como agente anestésico, con propiedades de amnesia, analgesia y efectos alucinogénicos, que actualmente ha demostrado propiedades antidepresivas. Fue sintetizada en 1962 por Stevens y utilizada en clínica en 1965 por Corsen y Domino (73). Se engloba entre las sustancias de “diseño” o de síntesis, conocidas en inglés como “club, o rave drugs”.
En los últimos años ha emergido como una sustancia de uso y abuso con fines no médicos. El uso crónico de ketamina se ha asociado con deterioro cognitivo crónico, síntomas psicóticos y disociativos, trastornos del estado de ánimo (que sugieren daño estructural cerebral) (73), y con otros síntomas físicos como retención urinaria crónica e insuficiencia renal. Hay que aclarar que las dosis recreacionales son más altas que las dosis terapéuticas. Los efectos agudos de la intoxicación por ketamina incluyen: midriasis, nistagmus, aumento de la presión arterial y de la frecuencia cardíaca, hiperpnea, alucinaciones que pueden ser terroríficas o plancenteras. La sobredosis produce depresión respiratoria, apnea y muerte. En un estudio realizado en USA (74) se encontró que la incidencia de situaciones de emergencia involucrando esta sustancia aumentó en un 81.1 % entre 2019 y 2021. El 57 % de los pacientes eran hombres, el 39 % reportaron abuso o mal uso del fármaco, y en el 19 % de los sujetos se sospechó intento de suicidio. El 19.6 % experimentaron efectos adversos graves o muerte. 33 % de los pacientes usaron concomitantemente otra sustancia: benzodiacepinas 14.6 %, alcohol 10.3 %, y opioides 8.7. Cuando se asoció la ketamina con gama-hidroxibutirato (GHB) y opioides, los resultados fueron más frecuentemente muy graves o la muerte.
Los estimulantes del SNC producen profundos efectos psicopatológicos en los animales y en el hombre. Pueden inducir psicosis endógena (anfetaminas, cocaína), así como ciertos casos de esquizofrenia y problemas de bipolaridad (72). Con el uso de estas sustancias se han reportado, además de las anteriores, las siguientes actitudes: estereotipos motores con movimientos bizarros: actividad repetitiva y sin motivo, como golpear con varios objetos, incluyendo partes del cuerpo; repetición de una palabra, frase o expresión musical; dibujos o frases escritas estereotipadas; actividad sexual muy prolongada sin eyaculación; monólogos prolongados; aislamiento social, sin respuesta a estímulos sociales; paranoia; alucinaciones e ilusiones visuales, táctiles o auditivas. El cese brusco en el consumo de estimulantes produce un síndrome de abstinencia.
Agentes inhalados (CIE 10: F.18).
Los disolventes orgánicos son sustancias que a temperatura ambiente se encuentran en estado líquido y pueden desprender vapores, por lo que la vía de intoxicación más frecuente es la inhalatoria, aunque también se puede producir por vía digestiva y cutánea. Los más habitualmente utilizados con fines ilícitos son
los pegamentos, el éter, el cloroformo, el quitamanchas etc. aunque también existen intoxicaciones laborales por exposición a estos solventes (75). El consumo de estos productos es más frecuente en adolescentes o personas muy jóvenes, especialmente de grupos marginados económicamente (76).
En anestesiólogos puede aparecer la habituación y consumo importante de óxido nitroso y otros agentes anestésicos inhalados, buscando su efecto sedante, lo que puede producir pérdida de la conciencia, hipoxia, broncoaspiración y en ocasiones la muerte. Las determinaciones de tóxicos en orina no detectan los agentes inhalados, aunque pudieran producir, después de consumo crónico, alteración de las enzimas hepáticas (75).
Alucinógenos (CIE 10: F.16).
Estas sustancias pueden ser: derivados de la triptamina (dimetilamina de ácido lisérgio -LSD- psilocibina, ayahuasca y dimetiltriptamina -DMT-); derivados de la fenilamina (mescalina y algunos alucinógenos de diseño) y otros (salvia divirnorum, hioscina). Todas, excepto los dos últimos, ejercen su acción agonizando total o parcialmente con el receptor serotoninérgico 5-HT2. Los efectos comprenden: alucinaciones visuales, distorsión del tiempo y el espacio, intensificación de los colores y cinestesias. La duración de los efectos depende del fármaco y la vía de administración. Cuando aparece una situación de urgencia es generalmente por un ataque de pánico, y usualmente el tratamiento será de soporte. Con el uso de estas sustancias, especialmente si se unen a otras, puede producirse un síndrome serotoninérgico (75). Algunas personas pueden revivir el efecto de los alucinógenos horas, días y aun años después de su consumo. Este fenómeno se llama trastorno persistente de la percepción causado por alucinógenos, y ha sido descrito más frecuentemente después del uso de LSD (75).
La lista de las sustancias psicoactivas es muy extensa, y sobrepasa los límites de este estudio. Como tema quizá para otro documento, queda la investigación acerca de las nuevas y potentes drogas o combinaciones que han hecho su aparición en el mundo, como la xilacina y el “krokodil” (droga zombie), con devastadores efectos ambos, y que ya han llegado a nuestro país.
Sólo nos resta mencionar que, en la búsqueda de la felicidad, comoquiera que se defina por cada persona, el humano puede recurrir al medio ambiente para encontrar lo que necesita en su interior (paz, tranquilidad, alegría). Muchas veces esta búsqueda puede llevar a la habituación
del uso de sustancias, o a la adopción de hábitos de riesgo (se tratarán en otro estudio), que le pueden llevar a perder su estabilidad emocional, familiar, laboral y económica.
Conclusión:
Se considera que la adicción es una patología de uso de sustancias, muchas de ellas ilícitas, así como mal uso y abuso de las mismas. El DSM-5 divide esta enfermedad en leve, moderada y severa, dependiendo de cuántos de once criterios diagnósticos se cumplen. La carga genética responde por el 50 % del riesgo de adquirir esta enfermedad. Las experiencias traumáticas de la niñez contribuyen también, así como el inicio temprano de consumo de estas substancias. Otros factores de riesgo son: trastornos psicológicos del eje I-II baja tolerancia al estrés, disforias, ansiedad, y baja capacidad de resiliencia. Se pueden observar también en personas con TUS rasgos de personalidad como impulsividad, tendencia a la compulsión, tendencia a conductas de riesgo, problemas de autocontrol y deseo de gratificación inmediata.
El anestesiólogo tiene una incidencia más alta que otros médicos en el problema de uso y abuso de sustancias psicotrópicas (TUS), quizá por la facilidad de acceder a opioides, propofol, midazolam, agentes anestésicos inhalados y otros. Aunque el trastorno por abuso de alcohol sigue siendo el problema más común, los casos de médicos seriamente afectados con TUS va en aumento en todo el mundo. Si revisamos que el 30 % o más de la población general puede manifestar uso o abuso de sustancias, en México más de 1,500 anestesiólogos podrían padecer este problema. Es hora de estar alerta; muchas veces por desgracia el primer signo reconocido de que alguien tiene esta afección puede ser la muerte de un médico por sobredosis accidental o deliberada. Aunque no existen datos completes en el mundo, puede ser que el suicidio sea la causa de muerte del 6-10% de los anestesiólogos (77). Si queremos prevenir esto, el TUS debe reconocerse temprano, que su familia, departamento, compañeros y hospital apoyen al paciente, y que se le proporcione tratamiento completo, lo que podría llevar a que un 75% de los afectados regresen a una práctica completa, si es que el enfermo coopera con los requerimientos de tratamiento y supervisión.
Bibliografía.
1. Solomon Garb. Drug addiction in Physicians. Anesthesia & Analgesia current researches. Vol 48, No.1. 1969.
2. Organización Mundial de la Salud “Neurociencia del con- sumo y dependencia de sustancias psicoactivas” 2004 ISBN 92 4 59124 X.
4. María Elena Medina-Mora; Tania ReaL; Jorge Villa- toro; Guillermina Natera. Las drogas y la salud públi- ca: ¿hacia dónde vamos? Salud pública Méx[online]. 2013; 55(1: [citado 2024-03-02], pp.67-73. Disponible en:
5. Las drogas, el cerebro y el comportamiento. NIH. https:// nida.nih.gov/sites/default/files/soa_sp_2014.pdf. Actual- ized 2014.
6. https://udgtv.com/noticias/nueva-ley-de-salud-men- tal-y-adicciones-se-aprobara-en-marzo/214651#:~:text=- La%20nueva%20legislaci%C3%B3n%20prev%C3%A9%20 la,320%20millones%20383%20mil%20pesos
7. https://www.gob.mx/salud/conadic/documen- tos/contexto-de-la-demanda-de-sustancias-ilici- tas-en-2022-2023-y-acciones-del-gobierno-de-mexi- co-en-materia-de-salud-mental-y-adicciones?state=pub- lished.
8. Flavia Serebrenic Jungerman, Hamer Nastasy Palhares Al- ves, Maria José Carvalho Carmona, Nancy Brisola Conti, André Malbergier. Anesthetic drug abuse by anesthesiolo- gists. Rev Bras Anestesiol. 2012; 62: 3: 375-386
9. https://www.elfinanciero.com.mx/salud/2023/02/15/ cuantas-personas-mueren-en-mexico-por-sobredosis-y- cual-es-la-droga-mas-usada/
10. hllls://utu u.paho.gfqlqsltat¡ciag12:10¿022-opg-conme- mara:dia:mundiâl-salud-mental-panel-iuilo- salud-pública. 11. Enoch, MA., Goldman, D. The genetics of alcoholism and
alcohol abuse. Curr Psychiatry Rep 3, 144–151 (2001).
https://doi.org/10.1007/s11920-001-0012-3
12. Karolis Baronas, Tautvydas Rancelis, Aidas Pranculis et al: Nove human genome variants associated with alcohol use disorders identified in a Lithuanian cohort.Acta medica
Lituanica, 2018, 25(1).
13. Kevin Mc Cauley. The neurobiology of addiction and re-
covery. https://www.dawnfarm.org/wp-content/up- loads/BrainAndRecoveryNeuroscienceOfAddictionHAND- OUTS-COLOR_01-19-2016.pdf
14. MaríaElenaMedina-Mora;TaniaReal;JorgeVillatoro;Gui- llermina Natera. Las drogas y la salud pública. ¿Hacia dónde vamos? Salud pública Mex.2013; 55(1)..
15. Brent McNicol. The biology of addiction. Can J Anesth/J Can Anesth 64, 141–148 (2017). https://doi.org/10.1007/ s12630-016-0771-2
16. https://www.proquest.com/openview/2498cc33f221a3b- 3820c10e95ff26f45/1?pq-origsite=gscholar&cbl=1818298
18. https://repositorio.21.edu.ar/bitstream/handle/ ues21/12830/Manual%20de%20adicciones%20para%20 psicologos%20especialistas%20en%20psicologia%20cli- nica%20en%20formacion,%20Elisardo%20Becona,%20 Maite%20Cortes,%202011%20(1).pdf?sequence=
19. https://www.cppm.org.ar/wp-content/uploads/2015/06/ DSMIV.pdf
20. https://www.dof.gob.mx/nota_detalle.php?codi- go=5652074&fecha=16/05/2022#gsc.tab=0
21. Lucha contra la depresión. obtenido de: httos:/lcevece. edomex.qob.mx/sites/cevece.edomex.qob.m>Otras lecturas:
1. Definition of Addiction. Available at: http://www.asam. org/for-the-public/definition-of-addiction
2. Schuckit MA. An overview of genetic influences in alcohol- ism. J Subst Abuse Treat. 2009;36:S5–1.
3. Dube SR, Felitti VJ, Dong M, et al. Childhood abuse, ne- glect, and household dysfunction and the risk of illicit drug use: the adverse childhood experiences study. Pediatrics. 2003;111: 564–572.
4. Oldham JM 1, Skodol AE, Kellman HD. Comorbidity of axis I and axis II disorders. The American Journal of Psychia- try, 01 Apr 1995, 152(4):571-578 https://doi.org/10.1176/ ajp.152.4.571.
Lo Que Hay que Conocer de Aspectos Ecográficos en la Vía Aérea
What You Need to Know about Ultrasound Aspects in the Airway
1Guadarrama-Quijada Francisco. 1Medico Intensivista.
Anestesia en México 2024;36(2):
Fecha de recepción diciembre 2023, fecha de revisión abril 2024, fecha de publicación mayo 2024 poximuz@gmail.com
Resumen.
En años recientes la tecnología de ultrasonido ha salido de los gabinetes radiológicos, y ahora se realiza a la cabecera del paciente, también ha dejado de ser de uso exclusivo de los médicos especialistas en radiología, y ahora se emplea en forma cotidiana por diferentes especialistas; a esta aplicación de la tecnología de ultrasonido a la cabecera del paciente se le denomina POCUS en la literatura en idioma inglés (Point Of Care Ultra Sound). El ultrasonido puede ser usado para la evaluación de la vía aérea (VA); se utiliza un transductor lineal para examinar las estructuras superficiales y un transductor convexo para examinar las estructuras profundas. El ultrasonido es seguro, reproducible, rápido, repetible, con amplia disponibilidad y debe ser usado en forma dinámica en el manejo de la VA para máximo beneficio (1).
Palabras clave. Ultrasonido, POCUS.
Abstract
In recent years, ultrasound technology has left radiology
offices, and is now performed at the patient’s bedside. It has also ceased to be used exclusively by doctors specializing in radiology, and is now used on a daily basis by different specialists; This application of ultrasound technology at the bedside is called POCUS in the English- language literature (Point Of Care Ultra Sound). Ultrasound can be used for evaluation of the airway (AV); A linear transducer is used to examine superficial structures and a convex transducer is used to examine deep structures. Ultrasound is safe, reproducible, rapid, repeatable, widely available, and should be used dynamically in the management of VA for maximum benefit (1).
Keywords. Ultrasound, POCUS.
Sonoanatomía de la vía aérea superior
En el ultrasonido (US) las estructuras óseas como el mentón, la mandíbula y el hueso hioides se observan como estructuras luminosas hiperecoicos con una sombra hipoecoica por debajo, las estructuras cartilaginosas como los cartílagos tiroides y cricoides se observan de forma hipoecoica homogénea, el músculo y los tejidos
Figura 1: vía transversa a nivel de la membrana tirohioidea (THM). E=Epiglotis, A-M= Interfase aire-mucosa, PES= Espacio pre-epiglótico,
SM=Músculos infrahioideos.
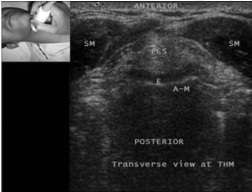
Predicción de Vía aérea Dificil con ultrasonido
Ezri y sus colaboradores reportaron el uso de ultrasonografía para predecir la dificultad para la intubación en pacientes obesos (2), la abundancia de tejido pre-traqueal (desde la piel hasta la superficie posterior de la tráquea, fue un predictor de laringoscopia dificil, en un artículo de revisión de (3) se encontró que se puede predecir una laringoscopía difícil en tres puntos: 1) la distancia hioides-menton, 2) el tejido anterior al hueso hiodes y 3) la membrana tiro-hioidea.
Ultrasonido de vía aérea instrumentada
Predicción del diámetro apropiado de tubo endotraqueal, endobronquial o de traqueostomía.
En niños y adultos jóvenes el ultrasonido puede medir en forma confiable el diámetro de la VA superior a nivel subglótico (4), en su artículo publicado en “Anesthesiology”, Shibasaki y colaboradores señalan que el ultrasonido es útil para este fin (Figura 2).
Las (Figuras 2 y 3) muestra la posición del transductor lineal para medición de diámetro subglótico:
Verificación de intubación orotraqueal con ultrasonido.
La capnografía ha sido considerada como el estándar de oro para confirmar la intubación traqueal, sin embargo, no está exenta de limitaciones, el paro cardiorrespiratorio y los estados de bajo flujo entre otros dificultan su uso, además no está disponible frecuentemente en los servicios de urgencias o terapia intensiva, por lo que el uso del ultrasonido resulta más práctico para este fin (5). Adi y colaboradores describieron que el uso del ultrasonido es tan bueno como la onda de capnografía para confirmación de la intubación oro-traqueal, con un tiempo medio de confirmación de 16.4 ± 7.3 segundos (6), en el ultrasonido subglótico el tubo endotraqueal puede observarse como el signo de doble vía “doublé tract sign”
Verificación de intubación esofágica con ultrasonido.
La presencia de una sonda traqueal en el esófago es mucho más fácil de apreciar con ultrasonido que la intubación traqueal, de hecho, para algunos autores después de intubar la ausencia de la imagen de intubación esofágica con ultrasonido es un dato confirmatorio de intubación traqueal,
Figura 4 y 5: intubación esofágica, vista con el transductor en posición supraesternal transversal, se observa una segunda imagen redondeada adyacente a la tráquea.


Verificación de la profundidad adecuada de la intubación traqueal con ultrasonido.
Existen dos formas de descartar la intubación bronquial con el ultrasonido, la primera es inflar el globo con solución salina (TRUST, Traqueal Rapid Ultrasound Saline Test), está
maniobra fue descrita por Tessaro y colaboradores en niños, el inflar el globo con solución salina facilita mucho observarlo en situación supraesternal lo que descarta la intubación bronquial (7), si el globo inflado no se observa en situación supraesternal ni en la tráquea ni en el esófago eso indica intubación bronquial.
La segunda forma de verificar con ultrasonido la profundidad de la intubación traqueal es colocando el transductor en el tórax del paciente en posición paraesternal en forma alternada a ambos lados del esternón para observar el deslizamiento pleural, si la punta del tubo se encuentra en un bronquio se observará deslizamiento pleural solo de ese lado y no se observará en el lado contrario, el deslizamiento pleural se produce con la ventilación espontanea o mecánica.
Ultrasonido para el manejo quirúrgico de la vía aérea
El ultrasonido es útil para identificar la membrana cricotiroidea y para identificar los anillos traqueales
En pacientes obesos o edematosos es díficil identificar la MCT, siendo en estos pacientes particularmente útil el uso del ultrasonido ya que se ha reportado mayor índice de éxito en la localización de la MCT con ultrasonido que con métodos clínicos como palpación y observación en este grupo y diferentes poblaciones de pacientes (8). Existen dos técnicas para identificar la MCT con ultrasonido, la técnica transversa o TACA y la técnica longitudinal (hilo de perlas)
El ultrasonido también es útil para determinar si el estómago se encuentra lleno o vacío, El ultrasonido puede identificar con más facilidad un estómago lleno que un estómago vacío (9), el examen se realiza en la posición de decúbito lateral izquierdo y con un transductor convexo de baja frecuencia (Figura 6 y 7).
Figura 6: examen del estómago con un transductor convexo de baja frecuencia para determinar estado de ayudo y contenido estomacal.
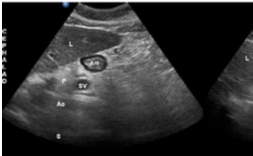
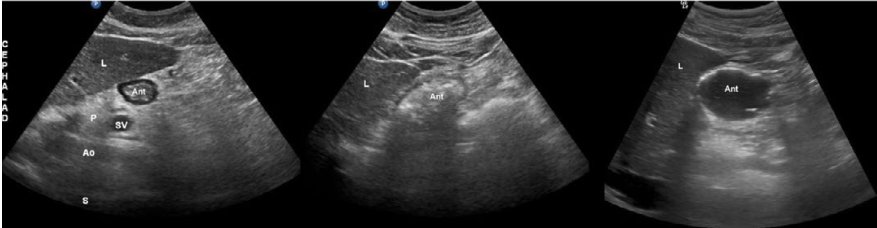

Referencias
1. MS, K. Ultrasonography in the management of the airway. Retrieved December 29, 2020, from https://pubmed.ncbi. nlm.nih.gov/22092121/
2. Ezri T, Gewurtz G, Sessler DI, et al. Prediction of difficult la- ryngoscopy in obese patients by ultrasound quantification of anterior neck soft tissue. Anaesthesia 2003;58(11):1111–4
3. Fulkerson J, Moore H, Anderson T, Lowe R. Ultrasonogra- phy in the preoperative difficult airway assessment. Re- trieved January 01, 2021, from https://www.ncbi.nlm.nih. gov/pubmed/27156094/
4. VG. Ultrasound assessment of subglottic region for esti- mation of appropriate endotracheal tube size in pediatric anesthesia. Retrieved 2021;12: from https://pubmed.ncbi. nlm.nih.gov/28781451/
5. Chou HC, Chong KM, Sim SS, et al. Real-time tracheal ultra- sonography for confirmation of endotracheal tube place-
7. 8.
9.
ment during cardiopulmonary resuscitation. Resuscitation 2013;84:1708-12.
Adi, O, Chuan, T.W, Rishya M. A feasibility study on bed- side upper airway ultrasonography compared to waveform capnography for verifying endotracheal tube location af- ter intubation. Crit Ultrasound J 5, 7 (2013). https://doi. org/10.1186/2036-7902-5-7
Chou HC, Tseng WP, Wang CH, et al. Tracheal rapid ultra- sound exam (T.R.U.E.) for confirming endotracheal tube placement during emergency intubation. Resuscitation 2011;82:1279-84.
Kristensen MS, Teoh WH, Rudolph SS, et al. Structured ap- proach to ultrasound-guided identification of the cricothy- roid membrane: a randomized comparison with the palpa- tion method in the morbidly obese. Br J Anaesth 2015; 114: 1003–1004
Jacoby J, Smith G, Eberhardt M, Heller M. Bedside ul- tra- sound to determine prandial status. Am J Emerg Med 2003;21:216–219
Vía Aérea Difícil no Anticipada en Cirugía Electiva, Paciente Ventilable no Intubable: Planeación de Estrategias y Revisión de la Literatura.
Unanticipated Difficult Airway in Elective Surgery, Non-Intubable Ventilable Patient: Planning Strategies and Review of the Literature
Anchondo A1, Acosta R2, Acevedo M3, Ruiz C4, Méndez A5.1Médico Anestesiólogo-Algologo en Hospital de Ginecobstetricia número 15, IMSS. Chihuahua. 2Médico Anestesiólogo en Hospital General Regional número 1 IMSS Chihuahua 3Médico Anestesióloga en Hospital de Ginecobstetricia número 15, IMSS. Chihuahua. 4Médico Anestesióloga en Hospital de Ginecobstetricia número 15 IMSS Chihuahua. 5Médico Residente de Especialidad en Anestesiología de segundo año en Hospital General Regional número 1 IMSS Chihuahua, Maestro en Dirección de Servicios de Salud. México.
Anestesia en México 2024; 36(2):
Fecha de recepción febrero 2024. Fecha de revisión marzo 2024. Fecha de publicación mayo 2024 drraulacosta@hotmail.com
La vía aérea difícil (VAD) no prevista, un escenario potencialmente catastrófico, afortunadamente poco frecuente. El equipo anestésico debe estar listo con planes estratégicos, que se puedan implementar de manera expedita, para garantizar una vía aérea (VA) permeable, y poder proveer ventilación y oxigenación, ante la incapacidad de canulación glótica.
En un escenario de VAD, el equipo de Anestesiólogos, deberá estar preparado para realizar intubación mediante laringoscopia directa, video-laringoscopia, implementación de anestesia regional para la VA, técnica de intubación con paciente despierto.
Todos los equipos anestésicos están expuestos a lidiar con
Se presenta un caso de un paciente para cirugía electiva, con un evento anestésico ventilable, no intubable, ameritando reversión farmacológica y emersión, para reprogramarlo en otro tiempo quirúrgico.
En el segundo tiempo Se realizó una planeación con abordaje transtraqueal, para colocación de catéter de tiroidotomía.
Palabras Clave: Vía aérea difícil no anticipada, anestesia regional de la vía aérea, paciente ventilable no intubable.
Abstract
The unforeseen difficult airway (DA), a potentially
catastrophic scenario, fortunately not that common, the anesthetic team must be ready with strategic plans that can be implemented expeditiously to guarantee an airway management and be able to provide ventilation and oxygenation in the case of inability to glotis cannulated. In a DA scenario, the anesthetic team must be aware of the availability of material resources and technical-practical skills of its members to be ready to perform intubation through direct laryngoscopy, video-laryngoscopy, implementation of regional airway anesthesia in order to facilitate a technique of intubation in an awake patient, the availability of supraglottic airway rescue equipment, can facilitate intubation, and the possibility of performing cricothyroidotomy. All anesthetic teams are exposed to dealing with a situation of a ventilatable, non-intubable or non-ventilable, non-intubable patient regardless of the level of care where they are located. A case is presented of a patient for elective surgery whose first anesthetic event is identified as being ventilatable, not intubable, warranting emersion and pharmacological reversal to be rescheduled for another event by having the necessary equipment to approach an airway that is difficult to intubate. Planning is carried out based on the algorithms of the American Society of Anesthesiology and Difficult Airway Society, performing regional anesthesia of the airway, using the transtracheal approach for catheter placement. Keyword: Unanticipated difficult airway, regional airway anesthesia, non-intubable ventilatable patient.
Presentación del caso
Mujer de 48 años, con diagnóstico de lesión de mama derecha clasificación BI-RADS 4B con colocación de marcaje con arpón. Programada de manera electiva, para biopsia intraoperatoria de ganglio centinela. Patologías de base negadas, encontrando hipotiroidismo subclínico sin tratamiento, identificado como hallazgo durante la verificación de exámenes de laboratorio en su valoración preoperatoria.
Estudios de laboratorio: Leucocitos 8.94K/uL, Hemoglobina 16.1g/dL, hematocrito 46.4 %, Plaquetas 336K/uL, tiempo de protrombina 12.3 segundos, INR 1.10. Tiempo de tromboplastina parcial 32.6 segundos, T3 total 1.1 ng/mL, T3 libre 3.1 pg/mL, T4 total 7.4 μg/mL, T4 libre 0.96ng/ mL, TSH 9.6 UIU/mL, creatinina 0.82 mg/dL, glucosa 88 mg/dL. La VA con estado dental optimo, sin prótesis ni piezas en mal estado, Khan I, Mallampati IV, Patil-Aldreti I, Bellhouse Dore I, distancia Inter incisivos Clase I, Índice de Arné 11 puntos. Cuello: Clasificación de bocio grado I de la OMS, sin desplazamientos de la VA identificados. Peso 63 kg, talla 1.53 m, IMC 26.9. Antecedente de manejo de
Ansiolisis con midazolam 1.5 mg intravenoso, analgesia con fentanilo 200 μg, lidocaína 60 mg, hipnosis con propofol 120 mg, relajación neuromuscular con cisatracurio 6 mg, con paciente en apnea, con ventilación manual por mascara facial y bolsa, con fracción inspirada de oxígeno (FiO2) al 100 %, sin presentar dificultad para la ventilación escala “HAN” grado I, después de tres minutos se realiza laringoscopia directa, hoja curva tipo MAC número tres, en donde se visualiza Cormack Lehane grado IV por médico residente, se intenta intubación con dispositivo Bougie, sin éxito, se retira laringoscopio y se establece situación de VAD con código verbal al equipo quirúrgico–anestésico y se solicita ayuda.
Segundo intento con videolaringoscopio (VL) McGRATH MAC con hoja MAC cuatro, visualizando epiglotis con incapacidad absoluta para la visualización de la glotis, se retira VL, se aspiran secreciones, se ventila paciente hasta obtener saturación parcial de oxígeno del 100 %. Se reposiciona paciente con rampa, se confirma la alineación de los ejes de la VA, y se realiza un tercer intento con VL con maniobra de BURP, obteniendo los mismos resultados. Por último, se realiza un cuarto intento con VL, maniobra BURP, y dispositivo Bougie sin éxito.
Se establece VAD ventilable no intubable, por la naturaleza electiva de la cirugía se decide revertir relajación neuromuscular y despertar a la paciente, para programarla al día siguiente con protocolo de VAD prevista. Se administran 300 mg de hidrocortisona, 2 mg de neostigamina y 600 μg de atropina, con reversión de relajación neuromuscular satisfactoria, ya con paciente en área de recuperación, consciente, se explica el evento de VAD no prevista, se resuelven dudas e inquietudes y se programa para el día siguiente con protocolo de VAD prevista. Se estableció un abordaje estratégico para el manejo avanzado de la VAD, con base a los algoritmos ASA (American Society of Anesthesiologists), DAS (Dificult Airway Society), cinco planes de abordaje:
A. Manejo avanzado de la VA e intubación de paciente despierto, con anestesia regional, guiada por ultrasonido (bloqueo de nervio laríngeo superior
B. Al realizar bloqueo transtraqueal dejar colocado catéter percutáneo 14G, para ventilación jet y como puente para intubación traqueal retrógrada con apoyo visual de videolaringoscopía y pinza Magill para tracción de guía
C. Mascarilla I-gel números 3, 4 y 5 (por su sello de presión de fuga orofaríngea de 25 cmH2O), como auxiliar de rescate de ventilación
D. Utilizar el catéter transtraqueal como cricotiroidotomía para ventilación jet
E. Traqueotomía abierta por el servicio de cirugía general. Ingresa a quirófano, ya incrementando el Arné a 21 puntos (por antecedente de intubación difícil [+10 puntos]), se solicitó ultrasonografía de cuello, VA y tiroides, no se documentó la presencia de adenopatías o lesiones nodulares o alteraciones del trayecto de la VA, lóbulos tiroideos en parámetros normales (lóbulo derecho 14 x 10 x 36 mm, lóbulo izquierdo 13 x 8 x 31 mm, istmo 2.5 mm)
Con medicación preanestésica de salbutamol (spray 2) inhalaciones, más beclometasona (spray 2) inhalaciones, dexametasona 8 mg intravenoso, ondansetrón 4 mg, metoclopramida 6 mg, con la lista de material de manejo avanzado VAD, monitoreo no invasivo, TA 110/65 mm Hg, FC 72 Lpm, Fr 18 rpm, SaO2 93 %, oxigenación- desnitrogenización, sedoanalgesia con fentanilo 100 μg y midazolam 1.5 mg.
Asepsia/antisepsia de cuello. Con apoyo ultrasonográfico identificación de referencias anatómicas de apófisis mastoides (Imagen 1) y ángulo mandibular (Imagen 2) se busca en línea intermedia el proceso estiloides (Imagen 3) y nervio glosofaríngeo. Infiltración peri-nerviosa con lidocaína 2 % 2.5 mL, repitiendo el procedimiento de forma contralateral; Se realizó identificación de cartílago cricoides y glándula tiroides, se palpo membrana cricotiroidea, luego se verifico por ultrasonido y se buscó la inserción de nervio laríngeo superior, hacia latero- superior, se infiltro lidocaína 2 % 2.5 mL de forma bilateral; Se preparó jeringa de 3 mL con lidocaína 1% 2 mL, catéter de acceso vascular periférico 14G (Punzocat), se identificó membrana cricotiroidea, punción con dirección cefálica, con aspiración continua, hasta detectar burbujas de aire, se retiró aguja, se fijó catéter. Posteriormente se administró lidocaína presentando el reflejo de tos esperado, logrando distribución y efectividad.
Se realizó video laringoscopia con hoja hipercurva. Se identificaron las cuerdas vocales. se ingresó tubo traqueal 6.5 diámetro interno con guía metálica moldeada, se verifica intubación traqueal por columna vapor y capnografía, se retiró guía metálica, neumo- taponamiento verificándolo en pantalla, se conectó tubo traqueal con curva de capnografía. El catéter cricotiroideo fue retirado, finalmente se procedió a complementar inducción intravenosa con fentanilo 200 μg, propofol 120 mg, cisatracurio 8 mg, mantenimiento con sevoflurano 2 Vol %, FiO2 60 %, ventilación mecánica AC/CV, Fr 12 rpm,
La emersión fue por lisis metabólica. Se le retiro el tubo traqueal a la paciente, por propia mano de manera planeada, pasa a unidad de cuidados post anestésicos hemodinamicamente estable, TA 126/60 mm Hg, FC 100 lpm, Fr 18 rpm, SaO2 93 %, sin complicaciones aparentes.
Imagen 4: Abordaje estratégico de la VAD prevista
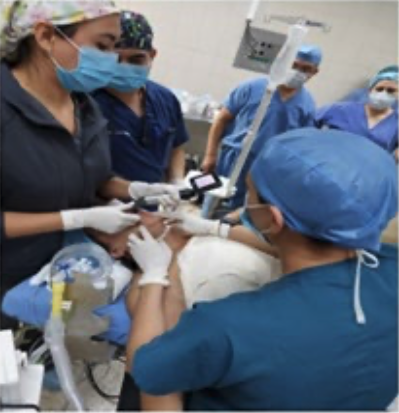
Discusión
La VAD es considerada como la dificultad de ventilar a un paciente por mascarilla facial o dispositivo supraglotico, así como la dificultad para la intubación por parte de un experto (1). La incidencia de VAD de intubar es rara, siendo descrita entre 5 y el 8 % sin embargo, la incidencia de VA no intubable es del 0.05 % al 0.35 %, a pesar de ser un escenario muy poco probable, la morbimortalidad asociada es alta, desde encefalopatía hipóxico-isquémica, con secuelas reversibles e irreversibles, hasta la muerte (1). En contraste, el éxito de intubación por laringoscopia directa y video-laringoscopía va del 92-94 % y 97.1-99.6 % respectivamente (1).
Según los algoritmos de la asociación americana de anestesiología ([American Society of Anesthesiologist] ASA por sus siglas en ingles), se debe realizar una evaluación de la VA previa a los procedimientos anestésicos, esta debe incluir predictores de VAD, riesgo de aspiración, examen
En cuanto a la preparación para el abordaje de una VAD prevista la ASA recomienda evaluar la disponibilidad de equipo para su abordaje, informar al paciente sobre el plan anestésico, plan para oxigenación-desnitrogenización previo y durante el procedimiento, posición del paciente, sedación, anestesia regional de las estructuras nerviosas implicadas, monitoreo del paciente, evaluación de los recursos y factores humanos (2). El abordaje de la VAD se recomienda con el paciente despierto, auxiliado de una aérea anestesiada para mejor tolerancia del paciente o ambas (2).
La Sociedad de la VAD ([Difficult Airway Society] DAS por sus siglas en ingles), en sus algoritmos para el abordaje de la VAD, establece que al identificarse, los primeros pasos a realizar es pedir ayuda, optimizar la posición del paciente, mejorar oxigenoterapia, utilizar relajantes neuromusculares de corta duración (si no se ha hecho antes) y solicitar fármacos que reviertan dicho efecto, realizar laringoscopia directa o video-laringoscopía, con un máximo de cuatro intentos, manipulación laríngea externa como la maniobra de BURP (Back, Up, Right, Push) , utilizar dispositivo Bougie (estilete plástico de intubación), entando verificando saturación de oxígeno por oximetría de pulso, en caso de no lograr la intubación declarar el fracaso de la intubación, rescatar ventilación con la posibilidad de utilizar mascarilla laríngea, en caso de ventilación manual convencional difícil, mientras se reevalúa el caso, y valorar riesgos y beneficios, sobre la posibilidad de despertar al paciente y/o realizar procedimiento quirúrgico, sin intubación (en caso de no existir comorbilidad asociada para estómago lleno o pulmonar, así como procedimiento de corta duración o inferior a 45-60 minutos, en base a la urgencia-emergencia, que amerito el manejo anestésico-quirúrgico), evaluar realizar cricotirotomía. La guía 2015 de la DAS NO recomienda la intubación retrógrada, menciona solo la Cricotirotomia en caso de no poder realizar una adecuada ventilación con dispositivo supraglotico.
La DAS recomienda, despertar al paciente, llevar a cabo ventilación con mascara facial y relajación neuromuscular, en caso de no ser efectiva, ventilación con dos proveedores, haciendo sello a dos manos, si no es posible ventilar al paciente en este punto, es necesario la declaración de paciente no ventilable, no intubable, ante este escenario la DAS recomienda utilizar la técnica de Cricotirotomia (3). La VAD de intubar, es responsable de casos de
La escala de Han fue descrita en 2004, asigna un puntaje de cero a cuatro, dependiendo la dificultad para ventilar a un paciente con mascarilla facial, se ha demostrado una correlación positiva, con la escala de Han y la clasificación de Cormack Lehane para predecir una vía aérea difícil de intubar (5).
La escala clínica multivariable también conocida como escala de Arné fue descrita en 1998, evaluando siete factores independientes, con un puntaje especifico cada uno, que incluye intubación difícil previa, patología asociada a ventilación difícil, síntomas de patología de VA, distancia entre incisivos, capacidad de luxación de mandíbula, distancia tiro-mentoniana, movilidad máxima de articulación del cuello, Mallampati modificado, donde se predice VAD, si la sumatoria de estos es mayor a once puntos, tiene una especificidad del 96 % y sensibilidad del 94 % (6).
El uso de video-laringoscopía en pacientes con VAD anticipada mejora la tasa de intubación en relación al uso de laringoscopio tradicional, la implementación de video- laringoscopia en VAD reduce los eventos adversos y la morbimortalidad (7).
Para la intubación del paciente despierto, disminuir salivación con anticolinérgico como atropina o glicopirrolato, su realización implica contrarrestar los reflejos protectores de la VA como la deglución y tos, así como analgesia del área para general un procedimiento más tolerable, aunque continúe siendo incómodo. El bloqueo del nervio glosofaríngeo para inhibir la deglución y dolor (faringe, orofaringe y lengua), en la actualidad se ha facilitado por guía ultrasonográfica, siendo un método efectivo, rápido y seguro (8). El nervio laríngeo superior, provee de sensibilidad a las cuerdas vocales, el bloqueo nervioso con ultrasonido ha demostrado ser más rápido y seguro, que cuando se hace con referencias anatómicas, siendo así una buena alternativa en los pacientes candidatos a intubación despierto (9). El reflejo de la tos, es el más incómodo para el paciente, debido a la punción transtraqueal, donde de instila lidocaína en la mucosa del lumen, provocando por medio de tos la difusión del anestésico local (10). En nuestro caso, se dejó catéter de bloqueo transtraqueal, para ventilación jet durante la videolaringoscopía, con la finalidad de prolongar los tiempos de oxigenación durante el procedimiento teniendo resultados favorables.
La intubación retrograda fue descrita durante los años 60 ́s por los médicos Butler y Cirilo, una de sus indicaciones puede
Debido a la implementación ultrasonográfica para la anestesia regional de la VA, el procedimiento fue eficaz, eficiente y efectivo para lograr una adecuada analgesia de la VA y poder limitar la profundidad de la sedación, al no contar con neuromonitoreo en el centro de trabajo, como lo es el índice biespectral, la profundidad anestésica fue una variable a controlar muy importante en esta paciente, hay muy poca literatura disponible sobre el neuromonitoreo para intubación de paciente despierto, sin embargo, es una herramienta a tomar en cuenta.
La cricotirotomía mediante punción percutánea transtraqueal, perforando la MC con un catéter venoso largo de preferencia 12 o 14G unido a una jeringa de tres cc sin embolo y un conector de tubo traqueal 6.5 DI se ha popularizado como técnica de rescate, en algunos hospitales con más recursos ya se encuentran equipos especiales para cricotirotomia, sin embargo, en México en las instituciones públicas es difícil o nula su disponibilidad. El apoyo de administración de oxígeno se facilita en la cricotirotomia realizando la llamada ventilación Jet que ayuda disminuir la acumulación de CO2 al fluir oxígeno en el espacio muerto anatómico de la vía aérea, desplazando el CO2 por un periodo corto de tiempo, se ha descrito desde los años 70 ́s como un procedimiento de rescate simple, relativamente seguro y muy efectivo
Los dispositivos extraglóticos (DEG) habitualmente conocidos como supraglóticos han tenido un impacto significativo en la práctica de la anestesiología desde su surgimiento y distribución en el año 1991. Los DE pueden usarse como rescate cuando no se puede intubar, son tres los factores más comunes para una inserción fallida; la experiencia del operador, técnica inadecuada, estado anestésico insatisfactorio (15). El dispositivo I-Gel manufacturado con gel termoplástico es una alternativa extraglótica para el manejo de la vía aérea avanzada, permitiendo la utilización de sonda de aspiración, así como su intercambio por tubo traqueal, posee una presión de sellado de hasta 25 cm H2O, contra 18 cm H2O proporcionados por otros DEG como LMA, Supreme, Fastrach entre otros (15). La seguridad de los DEG se basa en su presión de sellado, siendo a la vez un indicador para el uso de presión positiva bajo ventilación mecánica, la tasa de éxito en la inserción del dispositivo I-Gel al primer intento es del 76 % (17). En nuestro caso el dispositivo supraglótico de elección fue la mascarilla i-gel para rescate de la vía aérea.
El uso del dispositivo estilete de intubación “Bougie” puede facilitar la intubación hasta en el 78 % de casos, es considerado de fácil implementación, económico, sin embargo, puede prolongar los tiempos de intubación, y su rigidez ha reportado lesiones de esófago y tráquea por su colocación de intención rápida (18).
En el escenario de intubación con paciente despierto, deberá administrarse oxigeno suplementario durante
El Bocio es considerado como un aumento de la glándula tiroides, este aumento de tamaño puede potencialmente comprimir estructuras adyacentes su clasificación acorde a la Organización mundial de la salud tiene cuatro grados siendo grado 0 sin bocio palpable y grado tres, bocio visible a distancia (20). Se considera que la evaluación clínica del a vía aérea en pacientes con bocio sigue siendo útil para predicción de VAD, la inducción anestésica endovenosa y laringoscopia tradicional suele ser segura en pacientes con bocio, sin embargo, ante la sospecha de compresión de la vía aérea se debe individualizar el tamaño del tubo traqueal, el abordaje de estos pacientes no puede ser exitoso sin comunicación entre paciente, equipo quirúrgico y equipo anestésico (21). El bocio es conocido como una causa de desviación y compresión de la tráquea que en ocasiones puede ser asintomático y asignológico, la intubación con paciente despierto y uso de fibroscopio se considera el estándar de oro para el manejo de estos pacientes, sin embargo el anestesiólogo podrá utilizar otras técnicas descritas como laringoscopia o traqueotomía con paciente despierto, dependerá del escenario clínico y recursos disponibles, hasta el 14 % de los pacientes con bocio pueden tener complicaciones cardiorrespiratorias durante el procedimiento anestésico (22). En nuestro paciente se buscó de manera intencionada como una causa descrita comúnmente, sin embargo, el estudio de ultrasonografía descarto patología tiroidea, adenopatía y otras anomalías de vía aérea, sin embargo, recomendamos siempre realizar una valoración de la glándula tiroides y otras adenomegalias como parte de la exploración de vía aérea habitual como son los criterios descritos en la escala Arné como mínimo.
La DAS establece ocho recomendaciones para la intubación del paciente despierto (23), y agregamos en paréntesis recomendaciones propias
Conclusión
Ante un escenario no previsto de VAD, la calma y la capacidad resolutiva del equipo anestésico es clave, la comunicación con el equipo quirúrgico debe hacerse en tiempo real y óptimo, uno de los pilares en el manejo es la identificación temprana de VAD y la petición de ayuda. El establecimiento de un plan estratégico de acción para el abordaje sistematizado de la VAD provee seguridad al paciente, la máxima siempre será la ventilación de estos pacientes, por lo tanto, el contar con planes de rescate A
-B -C -D -E es fundamental.
La literatura disponible hace énfasis en la seguridad del paciente y prevención de complicaciones mediante la planificación estratégica, los recursos materiales disponibles marcan una brecha tangible en los resultados de los procedimientos anestésicos, afortunadamente, en nuestro caso el apoyo de equipos externos a los proporcionados por la institución utilizados por sus médicos anestesiólogos logro que el evento anestésico quirúrgico se efectuara de manera eficaz.
Referencias
1. Heidegger T. Management of the difficult airway. The new england journal of medicine. 2021; 384 (19): 1836-1847. Doi 10.1056/NEJMra1916801
2. Jeffrey L. et al. 2022 American society of anesthesiolo- gists practice guidelines for management of the difficult airway. Anesthesiology 2022; 136: 31-81. Doi. 10.1097/ ALN.0000000000004002
3. Difficult airway society (DAS) guidelines – overview algori- thm 2015. Doi 10.1093/bja/aev371
4. Rugnath N. et al. Unanticipated difficult airway during elec- tive surgery: a case report and review of literatura. Cureus 2022; 14 (12): 1-6. Doi 10.7759/cureus.32996
5. Vadillo S. et al. Escala de Han: utilidad en la predicción de intubación difícil. Acta medica grupo ángeles. 2015; 13 (2): 87-91.
6. Arne J. preoperative assesment for difficult intubation in general and ENT surgery: predictive value of a clinical mil- tivariable risk index. Br J anaesth 199; 80: 140-146 Doi. 10.1093/bja/80.2.140.
7. Lewis S. et al. Videolaryngoscopy versus direct laryngos- copy for adult patients requiring tracheal intubation: a Co- chrane systematic review. British journal of anaesthesia. 2017; 119 (3): 369-83 Doi 10.1093/bja/aex228
8. Liu Q. et al. Ultrasound-guided glossopharyngeal nerve block via the styloid process for glossopharyngeal neural- gia: a retrospective study.Journal of pain research 2019; 12: 2503-2510. Doi 10.2147/JPR.S214596
9. Lan C-H. et al. A new method for ultrasound-guided supe- rior laryngeal nerve block. Tzu Chi medical journal 2013; 25: 161-163. Doi 10.1016/j.tcmj.2013.05.001
10. Hernandez-Cortez E. et al. Intubación retrograda. Aneste- sia en México 2019; 31(1): 30-37.
11. DharaS.retrogradetrachealintubation.Anaesthesia2009; 64: 1094-1104. Doi 10.1111/j.1365-2044.2009.06054.x
12. OjedaJ.etal.Intubaciónretrogradamodificada.Revistacu-
bana de anestesiología y reanimación 2014; 13 (1): 84-96.
13. Benumof J. et al. The importance of transtracheal jet ven- tilation in the management of the difficult arway. Anes-
198911000-00023.
14. Duggan L. et al. Transtracheal jet ventilation in the ́çan ́t
intubate can ́t oxygenate ́emergency: a systematic review. British journal of anaesthesia 2016; 117 (s1): i28-i38. Doi 10.1093/bja/aew192
15. Hernandez M. et al. Evolution of the extraglottic airway: a review of its history, applications, and practical tips for suc- cess. Anesthesia & analgesia 2012; 114; (2): 349-368. Doi 10.1213/ANE.0b013e31823b6748
16. KomurE.etal.Comparisonofthesupraglotticairwaydevi- ces classic, fastrach and supreme laryngeal mask airway: a prospective randomised clinical trial of efficacy, safety and complications. Turk J anaest reamin 2015; 43: 406-11. Doi 10.5152/TJAR.2015.97830
17. Damodaran S. et al. Comparison of oropharyngeal leak pressure of air-Q, i-gel, and laryngeal mask supreme in adult patients during general anesthesia: a randomized controlled trial. Saudi J anaesth 2017; 11: 390-5. Doi 10.4103/sja.SJA_149_17
18. Bonnette A. et al. Bougie-Asisted endotracheal intubation in the pragmatic airway resuscitation trial. Resuscitation Author manuscript PMC 2022. Doi 10.1016/j.resuscita- tion.2020.11.003
19. Henriquez C. et al. Manejo de vía aérea difícil en pacien- tes con bocio maligno gigante: reporte de un caso. Rev Chil Anest 2021: 700-703.Doi 10.25237/revchilanes- tv5011081456
20. Coserria C. et al. Protocolo diagnóstico y terapéutico del bocio. Protocolos de práctica asistencial. Medicine 2012; 11 (14): 840-3. Doi 10.1016/S0304-5412(12)70393-
21. Pan Y. et al. Airway management of retrosternal goitters in 22 cases in a tertiary referral center. Therapeutics and cli- nical risk management 2020; 16: 1267-1273. Doi 10.2147/ TCRM.S281709
22. Davis J. et al. Airway management in a difficult intubation due to the presence of a goitter. Jour of clin cas rep, med imag and heal sci 2023; 5 (1): 1-4. Doi10.55920/JCR- MHS.2023.05.001193
23. AhmadI.etal.DifficultAirwaySocietyguidelinesforawake tracheal intubation (ATI) in adults. Anaesthesia. 2020; 75(4): 509–528.Doi :10.1111/anae.14904
Bloqueo Infraclavicular para Amputación de Mano en Lactante Cardiópata: Reporte de Caso.
Infraclavicular Block Approach for Hand Amputation in an Infant with Heart Disease: Case Report.
Loredo-García Nancy Guadalupe1,2, Campos-García David 1,3, Ham-Mancilla Ofelia1. 1Anestesiólogia Pediátrica, Instituto Nacional de Pediatría. 2Anestesia Regional, Anestesia Regional Monterrey 32Anestesia Regional, Instituto Nacional de Rehabilitación
Anestesia en México 2024;36(2):
Fecha de recepción febrero 2024. Fecha de revisión marzo 2024. Fecha publicación mayo 2024. nancy.loredo.garcia@hotmail.com
La implementación de anestesia regional en pacientes pediátricos y pacientes cardiópatas permite un gran beneficio. El control del dolor postoperatorio, es fundamental en esta población, para mejorar el estado respiratorio, atenuar respuesta neuroendocrina al estrés, y prevenir la amplificación de las vías del dolor, reduciendo complicaciones posoperatorias. Femenino 5 meses, 3.4 Kg, 61 cm. Diagnósticos: atresia pulmonar septum integro, comunicación interauricular; corto circuito de derecha a izquierda, insuficiencia cardiaca crónica agudizada, sospecha de error innato de inmunidad, traqueobronquitis moderada, neumonía adquirida en la comunidad, sepsis y coagulación intravascular diseminada remitidas. Estado postparo tardío, por hipoxia, necrosis distal secundaria a trombosis de mano derecha de 1a-5a falanges, necrosis de 2°-4° dedos de mano izquierda. Se le realiza amputación radio carpiana de mano derecha y fasciotomía de dedos de mano izquierda bajo anestesia general balanceada, y bloqueo de plexo braquial con
Palabras clave: Anestesia regional, infraclavicular, coracoideo, cardiopatía.
Abstract
Introduction: The implementation of regional anesthesia in pediatric patients and patients with heart disease, allows great benefit. Postoperative pain control is essential in this population to improve respiratory status, attenuate the neuroendocrine response to stress, and prevent amplification of the pain pathways. to reduce postoperative complications,
Case: Female 5 months old, 3.4Kg, 61cm. Diagnosis: pulmonary atresia with intact septum, atrial septal defect; right-to-left shunt, acute-on chronic heart
failure, suspected inborn error of immunity, moderate tracheobronchitis, antecedent community-acquired pneumonia and healthcare-associated sepsis, history of disseminated intravascular coagulation during sepsis, late postarrest status due to hypoxia, distal necrosis due to trombosis of the right hand of the 1st-5th phalanges, necrosis of the 2nd-4th fingers of the left hand, who underwent radiocarpal amputation of the right hand and fasciotomy of the fingers of the left hand under balanced general anesthesia and infraclavicular brachial plexus block coracoid approach with 1ml 0.2% ropivacaine maintaining hemodynamic stability, low anesthetic requirements, allowing extubation and FLACC 0 in the postoperative period.
Conclusion: It is important to implement effective and multimodal analgesic techniques to reduce adverse effects relating to pediatric anesthesia.
Keywords: regional anesthesia, infraclavicular, coracoid, heart disease.
Introducción:
La coagulación intravascular diseminada (CID) es un síndrome caracterizado por la activación sistémica de la coagulación, generando formación de fibrina intravascular, con trombosis de vasos de pequeño y mediano calibre, comprometiendo el flujo sanguíneo de los diferentes órganos. Además, el descenso de plaquetas, consumo de factores de coagulación y alteración de la fibrinólisis, predisponen a complicaciones hemorrágicas. La necrosis distal de extremidades superiores, presente en el paciente reportado se asoció a un evento trombótico, durante el curso de CID, contaba con otros factores de riesgo para la necrosis distal de extremidades: cardiopatía con stent en conducto arterioso, sin embargo, no se encontró presencia de émbolos o vegetaciones, la paciente además requirió de adrenalina, vasopresina durante el curso de sepsis. La anestesia regional en pediatría, disminuye el riesgo potencial a la exposición de los anestésicos inhalados, relajantes y opioides, permitiendo extubación temprana y control de dolor en el postoperatorio (1).
Caso clínico:
Paciente femenino de cinco meses, 3.4 Kg, 61 cm. Diagnósticos: atresia pulmonar con septum integro, Comunicación interauricular (CIA); corto circuito de derecha a izquierda, insuficiencia cardiaca crónica agudizada, sospecha de error innato de la inmunidad, traqueobronquitis moderada, neumonía adquirida en la comunidad, sepsis asociada a cuidados de la salud y CID remitidas, estado postparo tardío por hipoxia (10
minutos), necrosis distal secundaria a trombosis de mano derecha y mano izquierda. Antecedentes quirúrgicos: cateterismo y colocación de stent en conducto arterioso y atrioseptostomia con balón, colocación de catéter venoso central. A la exploración física activa, normocéfala, campos pulmonares sin agregados, oxígeno por puntas nasales 1l/min saturando 85 %, 61 % al aire ambiente, ruidos cardiacos rítmicos, soplo sistólico en foco pulmonar grado III, necrosis mano derecha de 1a-5a falanges, necrosis de 2° a 5° pulplejos de dedos de mano izquierda (Figura 1), resto de extremidades con llenado capilar dos segundos, pulsos radial y braquial bilaterales palpables, piel reticulada, presencia de catéter femoral izquierdo dos lúmenes, sonda orogástrica. Estudios de gabinete: Ecocardiograma: hipertrofia de ventrículo derecho, CIA 6×6 mm, corto circuito de derecha izquierda, insuficiencia mitral trivial, función de ventrículo único conservada, stent permeable. Radiografía de tórax: cardiomegalia ICT 0.63, flujo pulmonar disminuido. Electrocardiograma sin alteraciones. Laboratorios: destaca anemia normocítica normocrómica (Hb 9.5 g/dL), resto de laboratorios normales. Presentada para amputación de zona necrótica por riesgo de sepsis de tejidos blandos.
Manejo anestésico:
Se realiza monitorización tipo I; Tensión arterial 124/77 mmHg, Frecuencia cardiaca 145 lpm, Frecuencia respiratoria 30 rpm, temperatura 35.4°C, Pulsioximetria 87 %. Se induce con Fentanilo 10 μg i,v. lidocaína 3 mg, ketamina 3 mg, rocuronio 2 mg, ventilación asistida con FiO2 40 %, se realiza intubación orotraqueal con videolaringoscopio C-MAC hoja Miller 1, POGO 100 %, tubo orotraqueal número 3.5 con globo. Con paciente bajo efecto de anestesia general y con brazo en abducción y angulación a 90° (Figura 2), se realiza búsqueda de sonanatomía de plexo braquial a nivel infraclavicular coracoideo, observando adecuadamente las estructuras (Figura 3), se procede a realizar asepsia y antisepsia de zona, se introduce aguja de 25 mm en plano y se administra ropivacaína 0.2 % 1 mL (0.58 mg/kg, 0.32 mL/kg), previa hidrodisección con 0.5 mL de solución fisiológica, se realiza bloqueo sin complicaciones. Transanestésico: ventilación mecánica invasiva modo PCV: Presión inspiratoria 10 cm H2O manteniendo volumen corriente 6-7 mL/kg, Presión pico 15 cmH2O, I: E1:2, PEEP 4, FiO2 40 %, EtCO2 30 mm Hg, sevoflurano 0.2-0.3 CAM, logrando saturación por pulsioximetria 80-85 %, control de temperatura con calentadores de aire forzado manteniendo temperatura 35.8-36°C, hemodinamicamente estable. Adyuvantes: Paracetamol 35 mg, dexametasona 0.5 mg, gluconato de
Figura 1A: Necrosis de las cinco falanges distal, media y proximal que rebasa la mitad de zona dorsal de la mano.
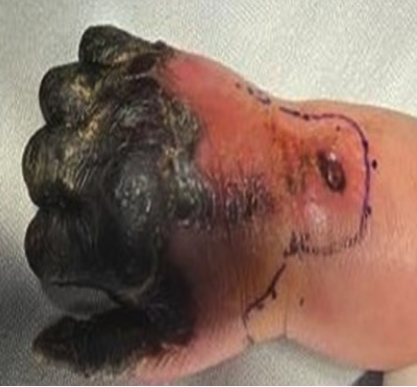
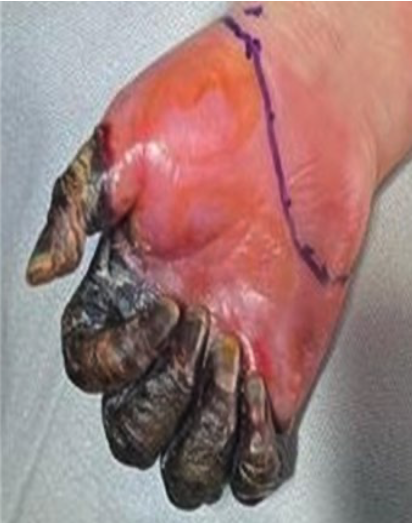
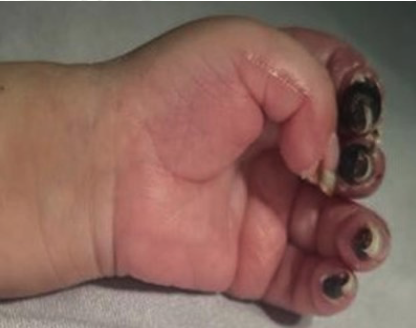
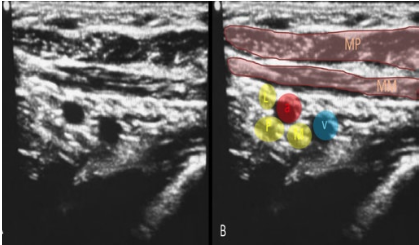
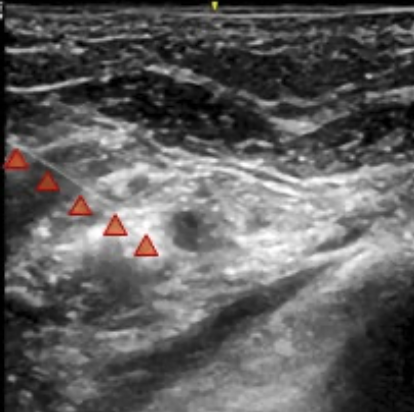
La anestesia regional proporciona analgesia perioperatoria, su implementación es de gran utilidad y seguridad (1,2), favoreciendo la recuperación postoperatoria, permitiendo alta domiciliaria temprana, disminuyendo efectos secundarios propios de la anestesia general como náuseas y
vómito, asociado a disminución de opioide, permitiendo extubación temprana, mejorando la satisfacción del paciente y familiares (1).
Se ha observado gran beneficio en pacientes pediátricos, particularmente en lactantes y neonatos, así como en pacientes cardiópatas. La anestesia regional es una excelente opción en cirugía de extremidad superior, los avances con el uso del ultrasonido para realizar estos procedimientos disminuyen las complicaciones relacio- nadas al abordaje del plexo braquial y mejora la calidad del bloqueo (1).
El plexo braquial desde su formación y durante su trayecto se encuentra adyacente a estructuras importantes como la arteria vertebral, nervio frénico, arteria subclavia y pleura, la cercanía a estas estructuras es más estrecha en pacientes pediátricos, por lo que el uso del ultrasonido se vuelve mucho más crítico en estas intervenciones, ayuda también a observar la difusión del anestésico local en tiempo real (3).
Se han descrito bloqueos con abordaje infraclavicular guiados por ultrasonido en pacientes entre cinco y 15 años de edad, sin complicaciones asociadas (4), destacan el costoclavicular y el coracoideo, los cuales se adecúan acorde al paciente (1).
En un estudio realizado en población pediátrica de 5-16 años se observó el bloqueo costoclavicular y coracoideo con cambios de posición del brazo en aducción y abducción observando adecuadamente las estructuras en todos los pacientes en la posición de abducción del brazo a 90 y 110°, que resulto en un inicio de bloqueo sensorial y motor, sin presencia de complicaciones relacionadas con la técnica (1).
El PRAN (Pediatric Regional Anesthesia Network) ha reportado un aumento de 23 % en el número de bloqueos de nervios periféricos al comparar los datos de 2007 y 2015, en gran parte por los abordajes más seguros con apoyo de ultrasonido (1,5,6) asociado también a la implementación de la analgesia multimodal (7). El ultrasonido ha permitido que estos bloqueos se realicen
de forma precisa, segura y con menores volúmenes de anestésico local en comparación con las técnicas a ciegas, lo cual no está recomendado dado paciente pediátrico (6,8).
Acorde al PRAN el 93.7 % de los bloqueos regionales se hacen bajo efectos de anestesia general, manteniendo al paciente inmóvil. Los lactantes tienen un alto riesgo de eventos adversos relacionados con la anestesia general en comparación con los niños mayores, estos riesgos se atribuyen a la evolución de la fisiología cardiovascular y respiratoria, mayor neuroplasticidad y a la vulnerabilidad del cerebro en desarrollo (11).
No se han reportado reacciones adversas neurológicas, cardiovasculares o respiratorias, ni signos clínicos de toxicidad en bloqueos periféricos de inyección única (5,7). La técnica debe adaptarse a los lactantes y recién nacidos tomando en cuenta las diferencias del desarrollo en la anatomía y fisiología (2,12)
Las dosis iniciales de anestésicos locales deben reducirse en los recién nacidos en aproximadamente un 50 % de la dosis equivalente en adultos por kg de peso corporal (2) y un 30 % en menores de 6 meses (12). Determinando la dosis máxima de bupivacaína en 0-6 meses de 0.5-1 mg/ kg, en mayores de seis meses 1-2 mg/kg, con ropivacaína en 0-6 meses de 0.5-1.5 mg/kg y mayores de 6 meses 1-3 mg/kg (2,16).
La implementación de las técnicas de anestesia regional se utiliza cada vez más durante las intervenciones en pacientes con cardiopatía, el control del dolor postoperatorio es fundamental en esta población para mejorar el estado respiratorio, atenuar la respuesta neuroendocrina al estrés y prevenir la amplificación de las vías del dolor, promoviendo la extubación temprana y reduciendo las complicaciones posoperatorias, la duración de la estancia hospitalaria y el costo general de la atención en la población.
El manejo está guiado hacia una tendencia a la analgesia multimodal (18). Acorde a la bibliografía revisada se implementó una técnica de manejo multimodal con bloqueo de plexo braquial abordaje infraclavicular coracoideo, con lo cual se mantuvo adecuada anestesia durante el transoperatorio, adecuada estabilidad hemodinámica, con mínimo requerimiento de opioide, permitiendo extubación al término del evento anestésico, manteniendo escala de dolor (FLACC) de 0 en las primeras horas del postoperatorio, el procedimiento se realizó de manera segura sin observar ninguna complicación.
Conclusiones
EL bloqueo infraclavicular para amputación de mano, es
una buena opción a la anestesia general, principalmente en población de neonatos o lactantes, con patología agregada grave.
Referencias:
1. Rocha-Cruz CA, Peña-Riverón AA, Campos-García D, Wied- man-Duart CS, Castañeda-Vázquez JL, Durán-Arizaga HJ. Efectividad del bloqueo de plexo braquial con abordaje costoclavicular y factores que modifican la sonoanatomía en pacientes pediátricos. Rev Mex Anest. 2022;45(4):226- 230. doi:10.35366/106340.
2. Morton NS. Local and regional anaesthesia in infants. Con- tinuing education in anaesthesia critical care & pain, 2004;4(5):148–151. https://doi.org/10.1093/bjaceaccp/ mkh041
3. Yayik AM, Cesur S, Ozturk F, Celik EC, Naldan ME, Ahiskalio- glu A. Comparison of the lateral sagittal and costoclavicular approaches for ultrasound-guided infraclavicular block in pediatric patients: a prospective randomized study. Braz J Anesthesiol. 2021;6(S0104-0014(21)00224-4):1-7. doi: 10.1016/j.bjane.2021.05.005. Epub ahead of print. PMID: 34090921.
4. De José María B, Banús E, Navarro Egea M, Serrano S, Perelló M, Mabrok M. Ultrasound-guided supraclavicular vs infraclavicular brachial plexus blocks in children. Pae- diatr Anaesth. 2008;18(9):838-44. doi: 10.1111/j.1460- 9592.2008.02644.x. Epub 2008 Jun 9. PMID: 18544144.
5. Relland LM, Neel ML, Gehred A, Maitre NL. Regional an- esthesia in neonates and infants outside the immediate perioperative period: A systematic review of studies with efficacy and safety considerations. Paediatr Anaesth. 2021;31(2):132-144. doi: 10.1111/pan.14042. Epub 2020 Nov 7. PMID: 33070411
6. Rai E, Naik Vi, Singariya G, Bathla S, Sharma R, Pani N. Re- cent advances in paediatric anaesthesia. Indian J. Anaesth. 2023;67(1):27-31, DOI: 10.4103/ija.ija_973_22
7. Vargas A, Sawardekar A, Suresh S. Updates on pe- diatric regional anesthesia safety data. Curr Opin Anaesthesiol. 2019;32(5):649-652. doi: 10.1097/ ACO.0000000000000768. PMID: 31415045.
8. Kaye AD, Green JB, Davidson KS, Gennuso SA, Brown ML, Pinner AM, et. al. Newer nerve blocks in pediatric surgery. Best Pract Res Clin Anaesthesiol. 2019;33(4):447-463. doi: 10.1016/j.bpa.2019.06.006. Epub 2019 Sep 20. PMID: 31791563.
9. Heydinger G, Tobias J, Veneziano G. Fundamentals and in- novations in regional anaesthesia for infants and children. Anaesthesia. 2021;76(1):74-88. doi: 10.1111/anae.15283. PMID: 33426659.
10. Walker BJ, Long JB, Sathyamoorthy M, Birstler J, Wolf C,
Bosenberg AT, et. al. An analysis of more than 100,000 blocks from the pediatric regional anesthesia network. Anesthesiology. 2018;129(4):721-732. doi: 10.1097/ ALN.0000000000002372. PMID: 30074928.
-
Squillaro A, Mahdi EM, Tran N, Lakshmanan A, Kim E, Kel- ley-Quon LI. Managing Procedural Pain in the Neonate Using an Opioid-sparing Approach. Clin Ther. 2019;41(9):1701- 1713. doi: 10.1016/j.clinthera.2019.07.014. Epub 2019 Aug 17. PMID: 31431300; PMCID: PMC6790974.
-
Feehan T, Packiasabapathy S. Pediatric Regional Anesthe- sia. In StatPearls. StatPearls Publishing. (2022). Recuper- ado en Diciembre 2023 de http://www.ncbi.nlm.nih.gov/ books/NBK572106/
-
Camfield AS, McCutchan A. Local Anesthetics in Children. In StatPearls. StatPearls Publishing (2023). Recuperado en diciembre 2023 de https://www.ncbi.nlm.nih.gov/books/ NBK572090/
-
Eizaga Rebollar R, García Palacios MV, Morales Guerrero J, Torres Morera LM. Bloqueos centrales en Pediatría: una revisión de la literatura actual. Rev Esp Anestesiol Reanim. (2016);63(2):91–100. doi:10.1016/j.redar.2015.03.004
-
Taenzer AH, Hoyt, M, Krane EJ, Walker BJ, Flack S, Bosen- berg A, et al. Variation between and within hospitals in single injection caudal local anesthetic dose: A re- port from the pediatric regional anesthesia network. Anesth Analg. 2020;130(6):1693-1701. DOI: 10.1213/ ANE.0000000000004447
-
Chen L, Shen Y, Liu S, Cao Y. Minimum effective volume of 0.2% ropivacaine for ultrasound-guided axillary bra- chial plexus block in preschool-age children. Sci Rep. 2021;11(17002). https://doi.org/10.1038/s41598-021- 96582-3
-
SureshS,EcoffeyC,BosenbergA,LonnqvistPA,deOliveira GS, de Leon-Casasola O, et. al. Medicine Recommendations on Local Anesthetics and Adjuvants Dosage in Pediatric Re- gional Anesthesia. Reg Anesth Pain Med. 2018;43(2):211- 216. doi: 10.1097/AAP.0000000000000702. PMID: 29319604.
-
Monahan A, Guay J, Hajduk J, Suresh S. Regional analgesia added to general anesthesia compared with general anes- thesia plus systemic analgesia for cardiac surgery in chil- dren: A systematic review and meta-analysis of random- ized clinical trials. Anesth Analg. 2019;128(1):130-136. doi: 10.1213/ANE.0000000000003831. PMID: 30300178.
Enfermedad de Pompe: Implicaciones del Manejo Anestésico. Reporte de caso.
Pompe Disease: Implications of Anesthetic Management. Case Report.
Vallejos-Mita Gloria Martha1, Loredo-García Nancy Guadalupe1. Peña-Olvera Silvia2. 1Residente de Anestesiología Pediátrica del Instituto Nacional de Pediatría. CDMX. 2Anestesióloga Pediatra adscrita al Instituto Nacional de Pediatría. CDMX.
Anestesia en México 2024;36(2):
Fecha de recepción abril 2024, fecha de revisión abril 2024, fecha de publicación mayo 2024. 170990.gloria@gmail.com
Resumen.
La enfermedad de Pompe es un trastorno metabólico, autosómico recesivo, que condiciona acumulación de glucógeno tipo II en los lisosomas, por déficit de la enzima alfa- 1-4 glucosidasa. El cuadro clínico se caracteriza por miopatía, con debilidad muscular progresiva y afección en diversos órganos y tejidos como corazón, músculo esquelético, hígado y sistema nervioso. Históricamente, los pacientes fallecían, el primer año de vida, secundario a insuficiencia cardíaca, por miocardiopatía hipertrófica e insuficiencia respiratoria, por debilidad de los músculos respiratorios. Sin embargo, con la introducción de la terapia de reemplazo enzimático en 2006, se ha modificado el curso clínico, y un mayor número de pacientes, son derivados para procedimientos quirúrgicos- anestésicos. Los pacientes con enfermedad de Pompe, tienen un alto riesgo de eventos adversos, relacionados con el manejo anestésico, más frecuentemente los relacionados a eventos cardiacos y pulmonares. Para un adecuado abordaje perioperatorio, dentro de los estándares de seguridad, es necesario conocer la fisiopatología de la enfermedad, y las
implicaciones anestésicas; el objetivo principal es brindar un manejo individualizado, acorde a las necesidades de cada paciente. Se presenta el caso de un paciente femenino de seis meses de edad, con diagnóstico de Enfermedad de Pompe que ingresa a quirófano de endoscopias, para colocación de sonda de gastrostomía, vía endoscópica bajo Anestesia General Balanceada.
Palabras clave: deficiencia de maltasa ácida, glucogenosis tipo II, enfermedad de Pompe.
Abstract
Pompe disease is an autosomal recessive metabolic disorder that causes type II glycogen accumulation in lysosomes due to a deficiency of the enzyme alpha-1-4 glucosidase. The clinical picture is characterized by myopathy with progressive muscle weakness and affection in various organs and tissues such as the heart, skeletal muscle, liver and nervous system. Historically, patients died in the first year of life secondary to heart failure due to hypertrophic cardiomyopathy and respiratory failure due to respiratory muscle weakness.
However, with the introduction of enzyme replacement therapy in 2006, the clinical course has been modified and a greater number of patients are referred for surgical-anesthetic procedures. Patients with Pompe disease have a high risk of adverse events related to anesthetic management, most frequently those related to cardiac and pulmonary events. For an adequate perioperative approach within safety standards, it is necessary to know the pathophysiology of the disease and the anesthetic implications; The main objective is to provide individualized management according to the needs of each patient. The case of a 6-month-old female patient with a diagnosis of Pompe Disease who enters the endoscopic operating room for endoscopic placement of a gastrostomy tube under Balanced General Anesthesia is presented.
Keywords: acid maltase deficiency, glycogenosis type II, Pompe disease.
Introducción
La enfermedad por almacenamiento de glucógeno tipo II conocida como enfermedad de Pompe o deficiencia de maltasa ácida, es causada por déficit de la enzima alfa- 1-4 glucosidasa. Es un trastorno metabólico autosómico recesivo, que provoca acumulación de glucógeno en los lisosomas de diferentes grupos celulares, principalmente musculares (1,2,3). Se le considera como el primer desorden por almacenamiento lisosomal; descrito en 1932 por el patólogo Holandés Johannes Pompe en una niña fallecida, por debilidad muscular grave, y miocardiopatía hipertrófica, con depósito de glucógeno, en corazón, hígado, riñones y en músculo esquelético, Herz en 1979, observó las vacuolas con depósito de glucógeno, por microscopía electrónica y describió la enfermedad por depósito lisosomal (4-6,13).
La incidencia de esta patología es de, 1:40 000 a 1:300 000, de acuerdo a la etnia y zona geográfica, con alta probabilidad de un subdiagnóstico, en regiones carentes de material y capacitación necesaria para el mismo (1,3,6). En Latinoamérica, la bibliografía existente, reporta casos aislados y series de casos, considerándose un problema de salud pública, por el curso crónico, riesgo de trastornos neurológicos importantes, riesgo de muerte prematura y por el deterioro en la calidad de vida (3,7,9-11,14). Históricamente, los pacientes con enfermedad de Pompe, de inicio temprano, se diagnosticaban alrededor de los cuatro meses, requerían soporte ventilatorio a los cinco o seis meses, y su supervivencia promedio era de entre ocho y nueve meses. Sin tratamiento, la mortalidad promedio,erade74%alañodeedadyde88%alos 18 meses, secundaria a insuficiencia cardíaca, por
miocardiopatía hipertrófica e insuficiencia respiratoria, por debilidad marcada de músculos respiratorios. El abordaje era meramente paliativo, enfocado al manejo de las complicaciones, conducta expectante y sin repercutir en el curso de la enfermedad. Con la introducción de la terapia de remplazo enzimático en 2006, se observaron modificaciones, en el curso clínico de la enfermedad, con disminución en la incidencia de disfunción orgánica grave, e incremento en la sobrevida (4-6,9-11).
Esto ha condicionado que un mayor número de pacientes, sean derivados a procedimientos quirúrgicos y anestésicos (cirugías relacionadas con el curos de la enfermedad, para tratamiento y manejo como catéteres, traqueotomía, gastrostomía, gastroyeyunostomía, funduplicatura, broncoscopia, además de cirugías fuera de lo habitual, por la mayor sobrevida de los últimos años como apendicectomias, toracotomías, etc.), existiendo un alto riesgo, de eventos adversos, relacionados con el manejo anestésico, principalmente cardio-pulmonares; es necesario conocer la fisiopatología de la enfermedad y las implicaciones del abordaje perioperatorio, con el objetivo de brindar un manejo individualizado y acorde a las necesidades de cada paciente.
Caso clínico.
Paciente femenina de seis meses de edad con 5 kg de peso. Dentro de sus antecedentes se refieren padres aparentemente sanos, embarazo normoevolutivo y nacimiento de término, mediante cesárea urgente, por bradicardia fetal. Presenta cuadros de infección de vías respiratorias de repetición, desde el mes de edad, en el cuadro actual, requiriendo ventilación mecánica, posteriormente presenta, por dificultad respiratoria asociada a neumonía con datos clínicos de insuficiencia cardiaca y regresión del neurodesarrollo, por lo que es internada en la unidad de terapia intermedia, en el Instituto Nacional de Pediatría y realiza el abordaje de la paciente.
Se interconsulta a cardiología pediátrica, por falla cardiaca, mismo que reportan ecocardiograma transtoracico 25.01.22 con hipertrofia biventricular, doppler de entrada de válvula tricúspide con relación E/A invertida, patrón de relajación anormal. Insuficiencia tricuspidea ligera, sin evidencia de obstrucción del tracto de salida del ventrículo izquierdo, disfunción sistólica y diastólica severa biventricular, FEVI del 25 %, se inicia tratamiento con furosemide, espironolactona y captopril.
Valorada por el servicio de genética con realización de pruebas enzimáticas (alfa-glucosidasa ácida con acarbosa 0.15 nmol/ mL, con valores de referencia 1.29-25.7 nmol/mL), pruebas genéticas estableciendo el diagnóstico de Enfermedad de
Al presentar cuadros respiratorios de repetición, es valorada por el servicio de gastroenterología pediátrica, se diagnostica alteración de la mecánica de la deglución, y se programa para colocación de sonda de gastrostomía, por vía endoscópica bajo anestesia.
A la exploración física se encuentra paciente con adecuado estado de hidratación, hipotonía generalizada, mal manejo de secreciones, ruidos cardiacos rítmicos, sin fenómenos agregados, campos pulmonares con hipoventilación bilateral, polipnea, retracción subcostal y disociación tóraco-abdominal requiriendo aporte de oxígeno por cánula nasal 3L/minuto (Imagen 1), a nivel abdominal con sonda transpilórica; estudios de laboratorio dentro parámetros aceptables para procedimiento (Tabla I). Ultimo ecocardiograma transtoracico, reportando miocardiopatía hipertrófica, función diastólica con patrón de relajación anormal, sin evidencia de obstrucción al tracto de salida del ventrículo izquierdo, función sistólica del ventrículo derecho conservada, función sistólica del ventrículo izquierdo conservada con FEVI 43 % posterior a segunda dosis de tratamiento, con remplazo enzimático donde se observa mejoría parcial de la función sistólica y diastólica con FEVI previa de 25 %.
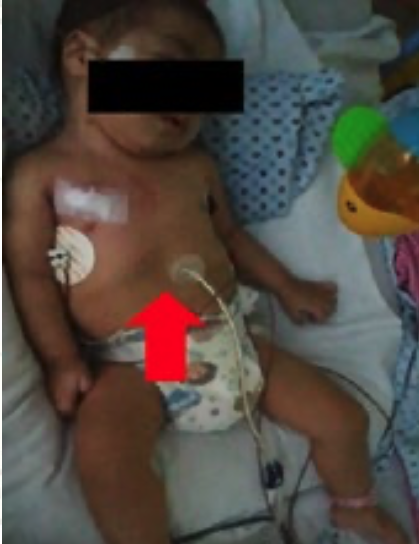
Ingresa a quirófano paciente reactiva con hipotonía generalizada, vía venosa periférica en dorso de mano derecha 24 G permeable de sala de internación con aporte de oxigeno por cánulas nasales a 3ml/min. Plan anestésico: Anestesia general balanceada, monitoreo no invasivo, tren de cuatro. Inducción intravenosa gradual con fentanilo 2 μg/kg, lidocaína 1 mg/kg, propofol 1 mg/kg, rocuronio 0.3 mg/kg. Videolaringoscopia con pala Tipo Miller número uno, POGO (percentage of
glottic opening) 50 %, intubación orotraqueal al segundo intento, con apoyo de Bougie; sonda orotraqueal de tres mm diámetro interno con globo, neumotaponamiento 0.3 mL, fijación a nueve centímetros de comisura labial izquierda. Verificación de posición mediante auscultación de campos pulmonares bilateral y capnografía; se conecta a ventilación mecánica, con modo ventilación controlada por volumen garantizado, con volumen tidal a 6 mL/kg, Frecuencia respiratoria (FR) 26 rpm, presión pico (PEEP) 4 cm H2O, relación inspiración-espiración 1:2. Mantenimiento anestésico con sevofluorano CAM 0.7-1 a FiO2 50 %. Transanestésico transcurre con estabilidad hemodinámica y ventilatoria. Adyuvantes: Cefalotina 30 mg/kg, paracetamol 15 mg/kg, dexametasona 0.1 mg/ kg. Concluye procedimiento sin otros incidentes; previo a extubación gasometría arterial con pH 7.35, pCO2 35, pO2 85, HCO3 23.3, déficit de base -3, hemoglobina ocho, glucosa 110, lactato 1.0. Se decide extubación con tres mediciones consecutivas de tren de cuatro por arriba de 90, sin complicaciones. Recuperación postanestésica manteniendo patrón ventilatorio optimo, con apoyo de oxígeno con vigilancia estrecha de signos vitales. Pasa a su unidad de hospitalización con cánulas nasales y oxígeno a 2 L/min, estable.
Discusión.
La literatura anestésica sobre la Enfermedad de Pompe es limitada y el conocimiento se basa en series e informes de casos.
En la forma infantil clásica se han descrito complicaciones cardíacas perioperatorias fatales relacionadas con la miocardiopatía hipertrófica y con la acumulación de glucógeno en el sistema de conducción cardíaco que predispone a alteraciones en las velocidades de conducción. Ambos estados se relacionan con un mayor riesgo de taquiarritmia y muerte súbita, especialmente en situaciones de estrés como infección, fiebre, deshidratación y periodo transanestésico (1,2,3,4). Algunos estudios refieren que los principales eventos adversos perioperatorios observados son desaturación (12.9 %), arritmias (3.8 %) e insuficiencia cardiaca (2.6 %); idealmente la terapia de remplazo enzimático debe iniciarse lo antes posible, una vez realizado el diagnóstico, incluso encontramos descrita la administración de la enzima por vía venosa periférica, hasta conseguir un acceso venoso central, dados los beneficios del tratamiento en pacientes, con terapia de reemplazo enzimático, la incidencia de complicaciones perioperatorias es relativamente baja. Actualmente se considera que el conocimiento de la fisiopatología de la enfermedad, la elección del momento
La vía aérea difícil no es una situación implícita en el paciente con enfermedad de Pompe. Sin embargo, deben considerarse características como macroglosia, debilidad de los músculos faciales, disminución en la sensibilidad faríngea y laríngea además de disfagia, condiciones relacionadas con mayor riesgo de broncoaspiración pre y posoperatoria. También se han referido eventos adversos respiratorios graves secundarios a debilidad de los músculos respiratorios, como aspiración repetida y necesidad de ventilación mecánica prolongada. Una recomendación pertinente ante este escenario es contar con el equipo necesario y el personal capacitado para enfrentar una potencial vía aérea difícil. (2,3,7.9).
Es fundamental el abordaje multidisciplinario y coordinado; inicialmente se debe realizar una valoración integral que impacte en la reducción de la morbi-mortalidad preoperatoria; se debe incluir estudios de laboratorio actualizados, valoración cardiológica completa (incluyendo elecgrocardiograma y ecocardiograma) y cuando sea factible valoración de la función pulmonar (polisomnografía, espirometría sentado y en supino) para evaluar el riesgo respiratorio, el tiempo de ayuno preoperatorio recomendado debe ser minimizado y administrar fluidos de mantenimiento durante el perioperatorio. Estos pacientes no deben ser considerados para procedimientos ambulatorios y contar con vigilancia estrecha posterior a un procedimiento quirúrgico-anestésico (5).
Los objetivos del manejo anestésico, deben ser dirigidos a preservar la perfusión coronaria y el gasto cardíaco (dependiente de la frecuencia cardiaca), manteniendo la precarga y postcarga. Estos pacientes son particularmente vulnerables durante la inducción anestésica a la caída del gasto cardíaco; así mismo se considera una vía aérea potencialmente difícil y con alto riesgo de dificultad del manejo ventilatorio, con necesidad de ventilación postoperatoria y dificultad en el destete del ventilador, por lo que es recomendable el uso de monitorización de relajación neuromuscular, debido a la sensibles al bloqueo neuromuscular, por la hipotonía y debilidad muscular de estos pacientes, se debe considerar además enfermedad del parénquima pulmonar (neumonías y episodios recurrentes de aspiración) (5,8.11).
Todos los fármacos anestésicos, han sido utilizados tanto con éxito como con complicaciones. El agente de inducción ideal, sería aquel que no altere los parámetros hemodinámicos, manteniendo particularmente, la presión
Fármacos inductores: Agentes que incluyen ketamina, propofol, sevoflurano, halotano, etomidato, tiopentona y midazolam, se han utilizado para inducir y mantener anestesia en estos niños. Los agentes deben ser titulados lentamente y en pequeñas dosis, para adecuarse al tiempo circulatorio prolongado, causado por la cardiomiopatía. Los fármacos que causan vasodilatación, disminuyen la presión arterial y el gasto cardíaco, y, por tanto, reducen la presión de perfusión coronaria es más probable que causen arritmias cardíacas y paro cardiaco.
Los agentes que mantienen la presión arterial, como la ketamina, están recomendados, las ventajas de la ketamina, son por su estimulación simpática, la cual aumenta la presión arterial, el gasto cardíaco y la perfusión coronaria, y mantiene la contractilidad y la resistencia vascular sistémica. La desventaja de la ketamina es, la taquicardia inducida por esta estimulación simpática. Cuando haya riesgo de isquemia miocárdica, es deseable mantener una frecuencia cardíaca normal, para permitir una mejor perfusión coronaria. Este efecto es particularmente relevante cuando existe una obstrucción del tracto de salida del ventrículo izquierdo. El midazolam, puede causar vasodilatación, lo cual resulta una ventaja, para reducir la dosis requerida, de otros fármacos anestésicos. El papel de agentes como etomidato, remifentanilo y dexmedetomidina en pacientes con enfermedad de Pompe tiene poca cobertura en la literatura médica, pero pueden suponer alternativas más seguras que los agentes anestésicos actuales en el futuro. Gracias a la terapia de reemplazo enzimático se han descrito casos con uso de propofol y sevoflurano de manera segura (6). Pacientes que han sido tratados con terapia de reemplazo enzimático, durante un período de tiempo, pueden tener un corazón de tamaño normal, pero el riesgo de arritmia aún persiste. Se debe tener en cuenta que aún puede ocurrir una depresión cardíaca moderada, al aumentar la presión inspiratoria y profundizar el nivel de anestesia a pesar de un informe de ecocardiograma preoperatorio normal. Por lo tanto, es deseable una titulación cuidadosa y gradual de los fármacos, a usarse independientemente de cuales sean (5,6).
Relajantes neuromusculares: Debe evitarse el suxametonio, en pacientes con enfermedad de Pompe, ya que en presencia de hipotonía y miopatía en estos niños existe un riesgo teórico de salida de potasio de las células, hiperpotasemia y rabdomiólisis, aunque no existen informes de casos de tal reacción en la literatura. Los relajantes neuromusculares no despolarizantes, deben
evitarse si es posible o usarse en dosis reducidas, ya que estos pacientes serán sensibles al bloqueo neuromuscular debido a su hipotonía y debilidad muscular por lo que de preferencia debe existir una titulación con monitorización de la relajación neuromuscular.
Bajo estas consideraciones recordemos que la cuenta del tren de cuatro es una excelente guía que nos informa no solo del grado de bloqueo neuromuscular sino también del estado de recuperación del mismo, especialmente en estos pacientes consideramos la posibilidad de bloqueo neuromuscular residual (la parálisis residual se define como TOF ratio < 0,92, por lo que sería recomendable para realizar una extubación segura un TOF ratio > 0,9) acorde a los valores del TOF se sugiere realizar reversión de bloqueador neuromuscular (12).
Opioides: Los opioides deben usarse con precaución en presencia de insuficiencia respiratoria, la cual a menudo se presenta en asociación con la debilidad de los músculos respiratorios. Es preferible en estos niños, un abordaje multimodal del dolor que incluya técnicas regionales (14). Anestesia regional: Debido al importante riesgo asociado a la anestesia general se debe considerar a la anestesia regional como una buena alternativa de elección cuando sea posible para niños con enfermedad de Pompe. La anestesia regional, se ha utilizado con éxito en muchos casos y ha incluido bloqueos del nervio femoral, bloqueos caudales, así como epidurales para biopsias musculares. No se han identificado complicaciones directamente relacionadas con los anestésicos locales, las complicaciones solo han surgido como resultado de los agentes anestésicos administrados para la sedación junto con el bloqueo (6,14).
La educación de la anestesia, debe producirse con una monitorización completa, teniendo cuidado para evitar una taquicardia. Se recomienda un enfoque multimodal para aliviar el dolor, con un uso cuidadoso de opioides, los cuales pueden exacerbar el compromiso respiratorio. El paciente debe ser monitorizado en la unidad de cuidados postanestésicos hasta que esté completamente despierto o sea trasladado a una unidad de cuidados intensivos (6,14). Todo esto con el fin de mantener estabilidad hemodinámica y optimizar la función respiratoria.
Conclusiones.
Nuevas estrategias terapéuticas han mejorado el pronóstico de pacientes con enfermedad de Pompe, y es más frecuente el encuentro de estos pacientes, para procedimientos bajo anestesia. Debido a las posibles complicaciones cardiopulmonares son de alto riesgo para el manejo anestésico. Su manejo requiere un
enfoque multidisciplinario y una estrecha cooperación. La anestesia, debe realizarse idealmente en un centro especializado. No existe un manejo anestésico ideal, sin embargo, el conocimiento de la fisiopatología de esta enfermedad nos orienta a una cuidadosa selección y titulación de fármacos apoyándonos de diferentes técnicas como la anestesia regional, con el objetivo de mantener la estabilidad hemodinámica y respiratoria del paciente.
Bibliografía.
1. Jegadeeswari A, Amuthan V. Janarthanan R. Murugan S. Balasubramanian S; Two cases of Pompe’s disease: case report and review of literatura; Indian Heart Journal 2012;6402: 214–216. doi: 10.1016/S0019-4832(12)60067- 4.
2. Kumbar V, Simha J, Gundappa P; Anaesthetic management of a patient with Pompe disease for kyphoscoliosis correc- tion. Indian Journal Anaesthesia 2016;60:349-351. doi: 10.4103/0019-5049.181597.
3. Bay L, Denzlerb I, Durandc C, Eiroad H, Frabasilc J, et al; Enfermedad de Pompe infantil: Diagnóstico y trata- miento; Arch Argent Pediatr 2019;117(4):271-278. doi. org/10.5546/aap.2019.271
4. Amartino HM, Cavagnari BM; Terapia de reemplazo enzi- mático en la forma infantil de la enfermedad de Pompe: experiencia de un caso con 7 años de seguimiento en Ar- gentina. Archivos argentinos de pediatría, 110(4), 323-327. https://doi.org/10.5546/aap.2012.323.
5. Bosman L, Hoeks SE, González Candel A, van den Hout HJM, van der Ploeg AT, Staals LM. Perioperative management of children with glycogen storage disease type II-Pompe disea- se. Paediatr Anaesth. 2018;28(5):428-435. doi: 10.1111/ pan.13361. Epub 2018 Mar 25. PMID: 29575534.
6. Meng-Chen L, Ming-Tse W, Kuo-Ting Ch, Dau-Ming N, Yu- Hsuan F., et al; Case Report: Anesthetic Management and Electrical Cardiometry as Intensive Hemodynamic Monito- ring During Cheiloplasty in an Infant With Enzyme-Repla- ced Pompe Disease and Preserved Preoperative Cardiac Function; Frontiers in pediatrics; Anesthetic Management in Pompe Disease; Publicado en línea el 13 de diciembre de 2021, volumen 9, doi: 10.3389/fped.2021.729824.
7. Castrillón Castrillón, D. P., Velasco Benítez, C. A, & Naran- jo, M. (2015). enfermedad de pompe: ¿Enfermedad rara o subdiagnosticada?. gastrohnup, 17(1). recuperado a partir de https://revistas.univalle.edu.co/index.php/gastrohnup/ article/view/1385
8. Richard J, Ryan D, Bengur RA, Williams EA, Eck J, et al; Anaesthetic management of infants with glycogen sto- rage disease type II: a physiological approach; Pedia-
9592.2004.01242.x.
9. De León NE, Seiglie-Díaz F, García A, Tápanes-Daumy I, Ver-
decia Cañizares C, et al.; Diagnóstico y tratamiento de la
enfermedad de Pompe; Rev Cubana Pediatr 2016; 88(3): 10. CerónM,ZamoraA,ErdmengercJ,UreñaR,SánchezA;First case of a patient with late-onset Pompe disease: Cardiom- yopathy remission with enzyme replacement therapy; Bol. Med. Hosp. Infant. Mex. vol.71 no.1 México ene./feb. 2014. 11. BarbaMA,BarrotE,BautistaJ,GutiérrezE,IllaS,etal;Guía clínica de la enfermedad de Pompe de inicio tardío; Rev
Neurol 2012; 54(8): 497-507.
12. Salas Ballestín A, de Carlos Vicentea J.C, Clavero Rubioa C,
Miralles Morellb F; Fracaso de extubación por bloqueo re- sidual prolongado tras vecuronio. Tratamiento con sugam- madex; Anales de Pediatria(Barc).2014;80(3):e92-e93. DOI: 10.1016/j.anpedi.2013.08.005
13. OrtizGiraldoB,CornejoOchoaJW;EnfermedaddePompe: descripción de las características clínicas y de laboratorio de una familia colombiana; Acta Neurol Colomb. 2011; vol 27(4); disponible en: https://www.actaneurologica.com/ index.php/anc/article/view/1462/1151
14. CuestaC;Recomendacionesparalaanestesiadepacientes con Enfermedad de Pompe; Disponible en https://www. orphananesthesia.eu/en/rare-diseases/published-guideli- nes/pompe-disease/1537-enfermedad-de-pompe-es/file. html
Eritropoyetina, una Alternativa de Tratamiento en los Pacientes Testigos de Jehová
Erythropoietin, a Treatment Alternative in Jehovah ́s Witnesses Patients
1Luna-González Arístides de Jesús. 1Hospital General Bicentenario Villaflores. Chiapas. México. Especialista en Anestesiología y Reanimación. Máster en Urgencias Médicas. Máster en Educación. Profesor Asistente, Investigador Agregado, Instructor BLS/ACLS por la AHA.
Anestesia en México 2024;36(2):
Fecha de recepción abril 2024, fecha de revisión abril 2024, fecha de publicación mayo 2024
aristidesjesus2012@gmail.com
Introducción: La medicina moderna realiza transfusiones de sangre diariamente, un procedimiento crucial para salvar vidas. Mientras tanto, millones se preparan para celebrar la Navidad en diciembre, un momento de alegría y reunión. A pesar de esto, los 19 millones de seguidores de los Testigos de Jehová tienen prohibido participar en estas actividades, ya que su religión lo prohíbe. Caso clínico: Una mujer de 24 años, testigo de Jehová, presenta dolor abdominal persistente y es diagnosticada con colecistitis aguda. Aunque necesita una transfusión sanguínea para la cirugía, se niega por motivos religiosos. Se recurre al uso de eritropoyetina como terapia alternativa para corregir la anemia y permitir la intervención quirúrgica. Discusión: El uso de la eritropoyetina ha crecido en varias áreas médicas, desde el tratamiento de la anemia en pacientes renales hasta la reducción de transfusiones en cirugías. Se destaca su eficacia en aumentar la producción de glóbulos rojos y reducir la necesidad de transfusiones sanguíneas, con administración subcutánea y
monitorización regular. Conclusión: El tratamiento con eritropoyetina ha probado su eficacia al elevar los niveles de hemoglobina y hematocrito, siendo una estrategia efectiva en la prevención de pérdidas sanguíneas en cirugías programadas. Esto reduce la necesidad de transfusiones alogénicas, disminuyendo la exposición a riesgos y mejorando los resultados clínicos.
Palabras clave: Pacientes testigos de Jehová, Alternativa eritropoyetina, Alternativa de transfusión.
Abstract
Introduction: Modern medicine performs daily blood transfusions, a crucial procedure to save lives. Meanwhile, millions prepare to celebrate Christmas in December, a time of joy and gathering. However, the 19 million Jehovah’s Witnesses are prohibited from participating in these activities due to their religion. Case Study: A 24-year- old Jehovah’s Witness woman presents with persistent abdominal pain and is diagnosed with acute cholecystitis.
Although she needs a blood transfusion for surgery, she refuses for religious reasons. Erythropoietin is used as an alternative therapy to correct anemia and allow surgical intervention. Discussion: The use of erythropoietin has grown in various medical areas, from treating anemia in renal patients to reducing transfusions in surgeries. Its efficacy in increasing red blood cell production and reducing the need for blood transfusions is highlighted, with subcutaneous administration and regular monitoring. Conclusion: Treatment with BIOYETÍN® has proven effective in raising hemoglobin and hematocrit levels, being an effective strategy in preventing blood loss in scheduled surgeries. This reduces the need for allogeneic transfusions, decreasing exposure to risks and improving clinical outcomes.
Keywords: Jehovah’s Witness patients, Erythropoietin alternative, Transfusion alternative.
Introducción
Cada día, la medicina moderna lleva a cabo un acto vital: las transfusiones de sangre, un procedimiento básico que salva vidas. Mientras tanto, en diciembre, millones alrededor del mundo se preparan para celebrar la Navidad, un tiempo de alegría y reunión. Además, hombres y mujeres en diversos países desempeñan con orgullo roles en el gobierno, sirviendo a sus naciones a través del servicio público. Sin embargo, para los 8 millones de seguidores de una religión relativamente joven, con distribución en 240 países, conocidos como los “Testigos de Jehová”, estas actividades están estrictamente prohibidas (1).
La negativa de los Testigos de Jehová a recibir transfusiones de sangre y consumir productos derivados de ella es ampliamente conocida. Asocian la transfusión de sangre con la alimentación y consideran que ambos son igualmente prohibidos. Esta postura ha generado numerosos debates y desafíos socio-médicos. Su prohibición se basa en la creencia de que la sangre es sagrada, justificada por su interpretación de textos del Antiguo y Nuevo Testamento.
Charles Taze Russell creó la versión moderna de los Testigos de Jehová en 1870 en Pittsburgh, Pensilvania. En 1931 adoptaron la denominación actual: Watch Tower Bible and Tract Society. En 1881, Russell y un grupo de amigos del movimiento fundaron como entidad legal la Zion’s Watch Tower Tract Society y la sociedad cambió más tarde su nombre por el de Watch Tower Bible and Tract Society of Pennsylvania, la que corresponde a la principal y más antigua entidad jurídica utilizada por los testigos de Jehová. Desde entonces, la sociedad comenzó a publicar y distribuir diversas publicaciones en distintos
Los testigos de Jehová aceptan la gran mayoría de los tratamientos médicos (“No tienen necesidad de médicos los sanos, sino los enfermos.”, Lucas 5:31). Pero en el caso de la transfusión sanguínea la situación es distinta. Basándose en diversos pasajes de la Biblia, tales como: “Solamente os abstendréis de comer carne con su alma, es decir, su sangre” (Génesis 9:4); “nadie de entre vosotros. comerá sangre” (Levítico 17:12), “… porque la vida de toda carne es la sangre; quien la comiere será exterminado” (Levítico 17:14). Los testigos de Jehová no aceptan de manera categórica la transfusión de componentes primarios de la sangre como son los glóbulos rojos, glóbulos blancos, plaquetas y plasma.
En la actualidad, la medicina transfusional desempeña un papel crucial como apoyo en numerosas ramas de la medicina. Sin embargo, es común que la decisión de realizar una transfusión de sangre o hemoderivados se tome sin una evaluación exhaustiva de los beneficios y riesgos involucrados. En ocasiones, esto significa pasar por alto los valores y preferencias de los pacientes, incluida su autonomía. Esta falta de evaluación adecuada puede llevar a transfusiones innecesarias, con consecuencias negativas para la salud y seguridad del paciente, así como la posibilidad de errores o eventos adversos.
Da Silva realizado una revisión que permitan abordar el tema de la transfusión sanguínea y componentes, sin embargo, por contexto el campo ha sido poco explorado, dado lo complejo del dilema ético, por lo que se han realizado investigaciones en alternativas que brinden apoyo para realizar una asistencia más resulta, preservado el derecho, moral del paciente y la objeción del equipo médico (3).
Además, esta situación puede tener implicaciones médico-legales significativas, especialmente cuando no se obtiene el consentimiento informado del paciente o su representante legal. Es fundamental respetar la autonomía del paciente y asegurarse de que estén plenamente informados sobre los riesgos y beneficios de cualquier procedimiento médico, incluidas las transfusiones de sangre. Solo así se puede garantizar una atención médica ética y de calidad, en la que las decisiones se tomen de manera informada y con el máximo respeto hacia los deseos y derechos de los pacientes, estos desafíos, constituye un estímulo a la investigación y desarrollo de nuevas alternativas en el tratamiento médico y quirúrgico que permita lograr la terapéutica sin la utilización de la transfusión de hemoderivados, Fonseca y Cuichan mencionan ̈Las acciones de mejora en la formación de los médicos a partir de los nuevos diseños curriculares
Mujer de 24 años, testigo de Jehová, que consulta por dolor abdominal del cuadrante superior derecho persistente, con hipersensibilidad y resistencia a la palpación. Clásicamente, se describe el signo de Murphy positivo en el examen físico, tratado inicialmente con analgésicos, sin mejoría evidente. Se le realiza ultrasonografía diagnóstica, donde se identifica engrosamiento de la pared vesicular mayor de 5 mm, líquido perivesicular y signo de Murphy ultrasonográfico positivo, con resultados en citometria hemática de hemoglobina de 12.8 g/dL y hematocrito de 38.4 %, por lo que fue valorada por el servicio de cirugía para realización de colecistectomía, sin embargo tras negarse a recibir una transfusión sanguínea con necesidad transfusional por estatus religioso, se implementa el uso de eritropoyetina, como terapia alternativa.
El presente trabajo enfoca una transfusión innecesaria desde el punto de vista ético, cuando un paciente, por motivos religiosos, se niega a recibir una transfusión, invocando principios éticos y derechos fundamentales de beneficencia y autonomía. Otra finalidad del presente reporte es inducir el análisis del problema, los factores que inciden en la autonomía del paciente que rechaza una transfusión por motivos religiosos, conocer el dilema en profundidad, así como la percepción del paciente sobre el problema y los conflictos que se asocian con la negativa a recibir terapia transfusional durante el momento de la atención médica inicial del procedimiento quirúrgico, que permita promover la reflexión del médico sobre la transfusión sanguínea y sus componentes en varios sentidos, que conduzcan a: 1) propiciar apertura y aceptación de los nuevos conceptos y conocimientos en la indicación de una transfusión de sangre o hemoderivados, así como de las diferentes alternativas para evitarla; 2) reflexionar sobre los conceptos legales y éticos cuando no se obtiene la aceptación del paciente o su representante legal y 3) considerar la percepción que se genera en los pacientes cuando no son atendidos por negarse a recibir una transfusión sanguínea, dígase situación de urgencia o sin ella.
La paciente fue beneficiada con el programa de pacientes quirúrgicos en cirugía programada con el uso de la eritropoyetina para reducir las transfusiones alogénicas, con Hb basal entre 10 y 13 g/dL
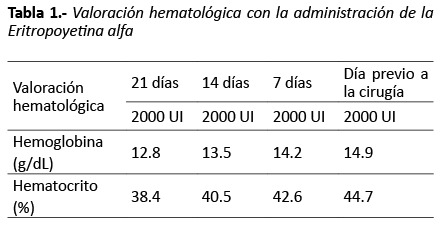
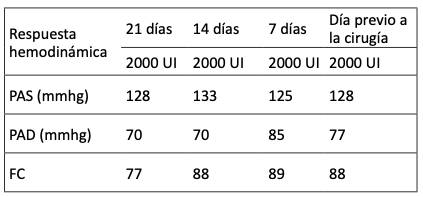
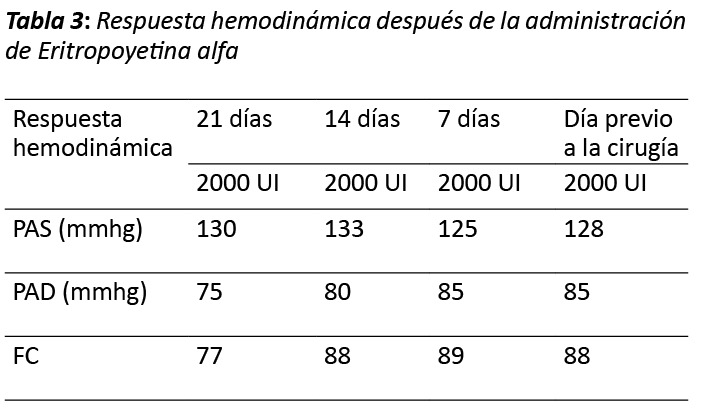
Discusión
Uso de la Eritropoyetina
El uso de eritropoyetina ha experimentado un rápido crecimiento en diversas especialidades médicas. Por ejemplo, en el tratamiento de la anemia en pacientes con insuficiencia renal, su aplicación se ha vuelto práctica común. Asimismo, su uso en otras indicaciones, como el tratamiento de la anemia en pacientes con cáncer, ha ido aumentando de manera progresiva. Recientemente, su empleo para reducir las transfusiones alogénicas en pacientes sometidos a cirugías ha ganado relevancia, destacándose como una estrategia crucial en la actualidad. Aunque el riesgo de transmisión de enfermedades a través de la transfusión sanguínea, ha disminuido considerablemente y sigue en descenso, es fundamental siempre considerar la relación entre el beneficio de la transfusión y la posibilidad teórica de efectos indeseables. Además, el incremento en la seguridad de los componentes sanguíneos ha llevado consigo un aumento significativo en los costos asociados con las transfusiones. En este contexto, el uso preoperatorio de eritropoyetina, emerge como una herramienta valiosa en la gestión de la anemia, contribuyendo a mitigar los costos y optimizar los resultados clínicos en el ámbito quirúrgico.
La Eritropoyetina humana recombinante (rHuEPO) es una glicoproteína glicosilada, obtenida por tecnología recombinante, con las mismas características biológicas de la EPO endógena (estimula la eritropoyesis, es esencial en la proliferación diferenciación y maduración de los glóbulos rojos y en la supervivencia de los progenitores de éstos en la médula ósea). Se conoce su poder terapéutico en pacientes con anemia e insuficiencia renal crónica y en la anemia secundaria al cáncer. Su forma de administración más efectiva es la subcutánea.
El efecto tras su administración es rápido, que oscila entre dos y tres días. El equivalente de una unidad de hemoconcentrados se produce en el séptimo día y el equivalente a cinco unidades a los 28 días.
Mecanismo de acción:
La eritropoyetina (Epo) ejerce su acción en la eritropoyesis a diferentes niveles, desempeñando un papel crucial en el proceso de producción de glóbulos rojos:
• Incrementa la diferenciación de las células precursoras
eritroides.
• Estimula la síntesis de hemoglobina.
• Reduce las etapas de maduración de los precursores
eritroides.
• Promueve la liberación de reticulocitos desde la
El uso combinado de la autodonación y la eritropoyetina, o la administración exclusiva de eritropoyetina alfa, se presentan como alternativas terapéuticas viables. Estas estrategias se destacan por su capacidad para aumentar la producción de concentrados de hematíes y reducir la necesidad de transfusiones de sangre de donantes alogénicos.
Existe evidencia de la eficacia de la administración de eritropoyetina alfa, en pacientes con niveles de hemoglobina entre 11-13 g/dL, lo que corresponde a un estado de anemia moderada. Sin embargo, no todos los estudios publicados respaldan estos efectos beneficiosos en pacientes con niveles de hemoglobina dentro del rango normal. Esta situación, junto con el costo económico asociado a la eritropoyetina, plantea un debate sobre su utilización en pacientes sin anemia, así como la posible inclusión en programas de autodonación.
La eritropoyetina tiene diversas indicaciones en el ámbito médico:
1. Tratamiento de la anemia y reducción de los
requerimientos transfusionales en pacientes adultos que están recibiendo tratamiento quimioterápico para mielomas, linfomas y tumores sólidos. Esta indicación se aplica especialmente en aquellos pacientes cuyo estado general sugiere un riesgo elevado de requerir transfusiones sanguíneas.
2. Incremento de la producción de sangre autóloga en pacientes que participan en programas de donación con predepósito. Esto implica que la eritropoyetina se utiliza para estimular la producción de glóbulos rojos propios del paciente antes de someterse a una cirugía u otro procedimiento que pueda requerir transfusiones de sangre.
3. Reducción de la necesidad de transfusiones sanguíneas en pacientes programados para cirugías mayores electivas. En este caso, la eritropoyetina se utiliza como parte de una estrategia para minimizar la exposición del paciente a transfusiones de sangre de donantes alogénicos durante o después de la cirugía.
4. Tratamiento de la anemia en recién nacidos prematuros. La eritropoyetina se emplea para abordar la anemia en bebés prematuros, ayudando a aumentar la producción de glóbulos rojos y mejorar la función de la médula ósea en este grupo de pacientes neonatales.
Estas indicaciones muestran la versatilidad de la eritropoyetina en el tratamiento y manejo de la anemia en diferentes contextos clínicos (5).
Además de las previas indicaciones, se han realizado
nuevas investigaciones en pacientes en estado crítico, de la Cruz, realizó un estudio en paciente quemado grave con anemia. Ella permite la recuperación de manera más sostenida de los valores de hemoglobina, se asocia a un mínimo de complicaciones y disminuye el uso de transfusiones de sangre que en ocasiones aumentan la morbilidad de estos pacientes (6).
Forma de administración:
La administración del fármaco se llevó a cabo por vía subcutánea en la región del deltoide. Se utilizó (eritropoyetina alfa) en una dosis de 2000 U.I. La administración se realizó en días específicos: 21, 14 y 7 días antes de la intervención quirúrgica. Durante este período, se evaluó la respuesta clínica y hemodinámica del paciente, así como se realizaron análisis hematológicos para valorar las variables de hemoglobina y hematocrito.
• Dosis inicial:
2000 U.I, tres veces por semana, vía subcutánea, los días 21, 14 y 7 previo a la intervención quirúrgica.
• Tratamiento complementario
A la paciente se le administró suplementos orales de hierro como complemento del tratamiento, puesto que la respuesta eritropoyética supone un consumo considerable del mismo. La dosis administrada fue de 200 mg de hierro elemental al día y se inició una semana antes de la administración de la eritropoyetina.
• Otros tratamientos
Se inició al mismo tiempo la instauración de un tratamiento suplementario de ácido fólico y de vitamina B12, conjuntamente con la terapia oral de hierro:
– 5 mg orales/día de ácido fólico.
– 1.000 gammas IM/semana de vitamina B12, durante el tratamiento con eritropoyetina.
Se ha comparado el efecto del hierro intravenoso en pacientes con anemia como alternativa a la transfusión sin embargo el resultado no es suficiente por su descenso en eritropoyesis, contra la eritropoyetina la cual tiene un mejor efecto ante la tasa de transfusiones sanguíneas, previamente se debe analizar además el estado en el que se encuentra el paciente ya que de ello dependerá el resultado, en pacientes con valoración preoperatoria como es el caso de nuestro paciente presento una mejoría a favor, sin embargo en pacientes que se encuentran en un estado crítico como menciona Moreira y Bravo, en pacientes con sangrado y en estado crítico la respuesta es menor y no se considera una terapia actualmente (7).
Monitorización de la respuesta
• El signo más precoz de respuesta se obtuvo a través del incremento del recuento absoluto de la Hb y el Hto, lo cual fue al menos 1 g/dL de Hb y alrededor del 1 % del valor del Hto, lo cual pudo ser detectado a partir de los siete días de tratamiento, valorando la respuesta clínica y hemodinámica.
• Se realizaron determinaciones de la Hb y el hematocrito, de forma periódica, para el control; pero también resultó de interés la valoración de las cifras de presión arterial y frecuencia cardíaca.
Conclusión
El tratamiento con eritropoyetina ha demostrado ser eficaz en el aumento de los niveles de hemoglobina y hematocrito. Por lo tanto, resulta una estrategia efectiva en la prevención de las pérdidas sanguíneas en pacientes programados para cirugías mayores electivas. Esta acción contribuye significativamente a reducir la necesidad de transfusiones de sangre de donantes alogénicos en aquellos pacientes que tienen un riesgo elevado de requerir transfusiones durante o después de la cirugía. En consecuencia, el uso de este fármaco garantiza una disminución sustancial en la exposición a transfusiones sanguíneas externas, lo que a su vez puede reducir potenciales complicaciones y mejorar los resultados clínicos en estos pacientes
Referencias
1. JW.org. Testigos de Jehová. Informe del año de servicio 2019: mayor número de bautizados en 20 años. 2019 [con- sultado el 20 de marzo del 2024]. Disponible en: https:// www.jw.org/pt/noticias/por-regiao/mundial/Relat%C3%- B3rio-do-ano-de-servi%C3%A7o-de-2019-maior-n%C3%- BAmero-de-batizados-em-20-anos/
2. Abad Vila, M. Vida para Ruth (1962) de Basil Dearden y el veredicto (2017) de Richard Eyre. Los testigos de Jehová y las transfusiones de sangre: dos visiones cinematográficas del mismo dilema. Revista de Medicina y Cine 2021; 17(4): 264 p. https://dx.doi.org/10.14201/rmc2021174263274
3. Da Silva Rodríguez QP, Lins SM DSB, Pérez EM, de Moraes ÉB, da Silva Campos T. Transfusão de sangue e hemocom- ponentes para as Testemunhas de Jeová: revisão de es- copo [Blood and blood component transfusion for Jeho- vah’s Witnesses: a scoping review][Transfusión de sangre y hemocomponentes para los Testigos de Jehová: revisión del alcance]. Revista Enfermagem UERJ, 2022;30:1-11 e65063-e65063, DOI:http://dx.doi.org/10.12957/reu- erj.2022.65063
5. Contreras EC. Guía de utilización de la eritropoyetina. (Cap. 11: Uso de la eritropoyetina) 2021;225-241. Sociedad Espa- ñola de Hematología y Hemoterapia (SEHH). https://www. sehh.es/archivos/informacion_fehh_fondo_capitulo11.pdf
6. de la Cruz García G. Utilidad de la eritropoyetina en el pa- ciente quemado grave con anemia. Revisión del tema. Ga- ceta Médica Espirituana, 2020;22(1): 60-70.
7. Moreira TEA, Bravo ELV, Álava VKL, Mendoza MAA. Sangra- do, transfusión y alternativas a la transfusión de paciente crítico. Domino de las Ciencias, 2023;9(3): 903-917. DOI: https://doi.org/10.23857/dc.v9i3.3477
Diagnóstico y Tratamiento de Sobrecarga Hídrica en el Posoperatorio Inmediato, en un Paciente Neuroquirúrgico
Diagnosis and Treatment of Fluid Overload in The Immediate Postoperative Period of a Neurosurgical Patient
Wilson-Manríquez Eduardo Antonio1, Nieto-Rizo, Javier Nieto1, 1Instituto Nacional de Neurología y Neurocirugía “Manuel Velasco Suárez” CDMX.Anestesia en México 2024;36(2):
Fecha de recepción marzo 2024, Fecha de corrección marzo 2024, Fecha de publicación mayo 2024 wilson61723@gmail.com
Resumen.
El manejo de líquidos perioperatorio es un reto para el neuroanestesiólogo, la sobrecarga hídrica en estos pacientes puede ser catastrófica. Nuestro caso describe la aplicación novedosa de un sistema de puntaje de sobrecarga venosa guiado por ultrasonido en el posoperatorio inmediato para guiar descongestión hídrica en un paciente posoperado de resección de un glioblastoma occipital. El tratamiento se realizó de forma individualizada, logrando una adecuada evolución del paciente.
Palabras claves: Sobrecarga hídrica, VExUS, Neurocirugía
Abstract
Perioperative fluid management is a challenge for the neuroanesthesiologist, fluid overload in these patients can be catastrophic. Our case describes the novel application of a score of venous overload guided by ultrasound in the immediate postoperative period to guide fluid decongestion in a patient operated of resection of
occipital glioblastoma. The treatment was individualized, and the patient had a favorable outcome.
Keywords: Fluid overload, VExUS, Neurosurgery
Introducción.
El manejo de líquidos perioperatorio es un aspecto sobresaliente para el neuroanestesiólogo, intentando mantener perfusión tisular sistémica, sin comprometer flujo sanguíneo cerebral, secundario a edema cerebral. La sobrecarga hídrica en esta población quirúrgica puede ser catastrófica, llevando a complicaciones multisistémicas, que traducen a mayor estancia intrahospitalaria y aumento de mortalidad. En el 2020, fue propuesto el sistema de puntaje de Exceso Venoso Ultrasonográfico (VExUS) para clasificar la severidad de congestión venosa sistémica, basado en los hallazgos ultrasonográficos (Figura 1 y Tabla 1)1.
Nuestro caso describe la aplicación novedosa en el posoperatorio inmediato, para guiar descongestión hídrica en un paciente posoperado de resección de un
glioblastoma occipital.
Caso clínico
Un masculino de 76 años, presentó un glioblastoma occipital, con crisis epilépticas de inicio tónicos-clónicos generalizados. Antecedentes patológicos de hipertensión arterial sistémica en adecuado control, así como enfermedad renal crónica KDIGO 3b. Ingresa a quirófano para resección microquirúrgica con mapeo cortical bajo anestesia total intravenosa, guiado por neuromonitoreo Massimo Sedline. El período intraoperatorio cursa sin incidentes, con resección completa de lesión en bloque, balance hídrico positivo 1726 mililitros, se mantiene hemodinámicamente estable y es extubado exitosamente con trasladado a la unidad de terapia intermedia. A los 30 minutos de su ingreso, presentó deterioro neurológico con Escala Coma Glasgow de siete puntos, se decide reintubar de urgencia en cama, e inicio de vasopresor norepinefrina 0.1 μg/kg/min. Se mantiene sedado y con ventilación mecánica invasiva. Una gasometría de ingreso a unidad revela pH arterial 7.049 con PCO2 81.3 mm Hg. Por evolución tórpida e inestabilidad hemodinámica, se realiza rastreo cardiopulmonar y protocolo VExUS. En ambos pulmones se observan líneas A y probable derrame pleural bilateral. El ecocardiograma transtorácico con cavidades normales, sin alteraciones de movilidad ni del engrosamiento del ventrículo izquierdo en reposo, fracción eyección biventricular conservada y derrame pericárdico leve. Protocolo VExUS revela vena cava inferior mayor a 2.1 cm con menor de 50 % colapsabilidad, Doppler de vena suprahepática con patrón s menor D (Figura 2). Doppler vena porta con índice pulsatilidad 40 % (Figura 3) y Doppler venoso intrarrenal bifásica (Figura 4).
Con los parámetros anteriores se integra un VExUS grado III con congestión venosa severa. Se sospechó insuficiencia respiratoria y deterioro neurológico por hipercapnia. Se indicó de inmediato restricción hídrica con balances negativas.
Se inició furosemida intravenosa con horario y medidas de protección neurológica, pulmonar y renal. Una tomografía de tórax simple reveló derrame pleural bilateral, atelectasia bilateral y derrame pericárdico (Figura 5). El paciente presentó la siguiente evolución intrahospitalaria:
• Día +2, VExUS grado II
• Día +7, extubación
• Día +8, egreso UTI
• Día +18, egreso hospitalario
Discusión
La congestión venosa perioperatoria puede causar lesiones por hipoperfusión a múltiples sistemas (renal, hepático e intestinal) secundario a reducción de presión de perfusión tisular. El protocolo VExUS es el primer puntaje objetivo para clasificar congestión venosa multisistémica.
La integración de múltiples valores de Doppler establece un grado desde cero hasta tres, con un aumento lineal de complicaciones conforme se aumente el grado. Su estudio original detectó mayor incidencia de lesión renal aguda relacionado a grupo VExUS III1.
Se ha descrito su uso para guiar manejo de líquidos en síndrome cardiorrenal, determinar causa de lesión renal aguda, predecir lesión renal aguda posoperatoria, evaluar disfunción ventricular derecha y guiar manejo de líquidos en insuficiencia cardíaca congestiva2,3. Nuestro caso es la primera descripción del uso de protocolo VExUS en un paciente neuroquirúrgico. Nos permitió un manejo de líquidos guiado por objetivos estandarizados en un paciente con un estado posquirúrgico lábil. Hace falta realizar más estudios aplicando VExUS en el período perioperatorio para determinar su rol y reconocer posibles limitaciones.
Tabla 1. Clasificación VExUS. Tomado de Beaubien-Souligny W, et al. 2020, doi:10.1186/s13089-020-00163-w.
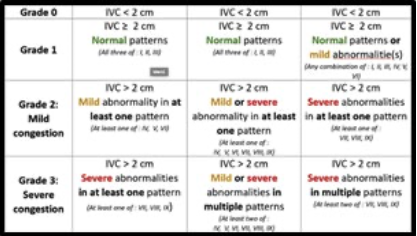
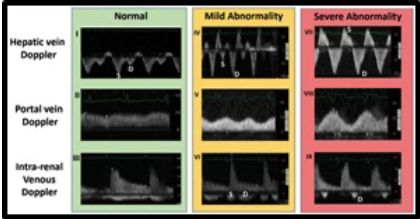
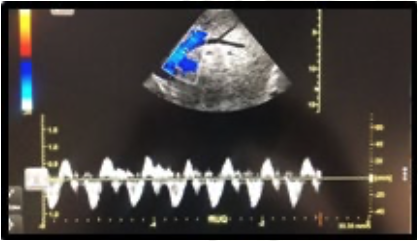
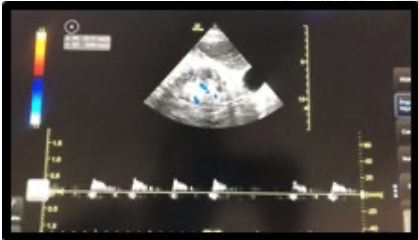
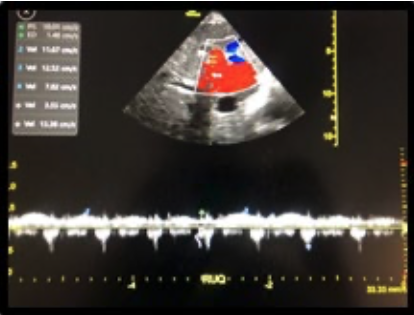
Referencias
1. Beaubien-Souligny W, Rola P, Haycock K, Bouchard J, La- matche Y, Spiegel R, et al. Quantifying systemic congestion with Point-of-Care ultrasound: development of the venous excess ultrasound grading system. Ultrasound J. 2020; 9;12(1):16. doi:10.1186/s13089-020-00163-w.
2. Rola P, Miralles-Aguiar F, Argaiz E, et al. Clinical applications of the venous excess ultrasound (VExUS) score: conceptu- al review and case series. Ultrasound J. 2021; 19;13(1):32. doi: 10.1186/s13089-021-00232-8.
3. Singh S, Koratala A. Utility of Doppler ultrasound derived hepatic and portal venous waveforms in the manage- ment of heart failure exacerbation. Clin Case Rep. 2020; 20;8(8):1489-1493. doi: 10.1002/ccr3.2908.
Manejo de la Vía Aérea en Neonato con Linfagioma Gigante: Reporte de caso
Airway Management in Neonate with Giant Lymphangioma: Case Report
1Hernández-López Jeaninne, Médico Anestesiólogo residente de la especialidad de Anestesiología pediátrica, Centro Médico Nacional Dr. Gaudencio González Garza, del Instituto Mexicano del Seguro social. 2Cortés- Julián Leticia, Médico Anestesiólogo pediatra, adscrito al servicio de anestesiología, del Centro Médico Nacional Dr. Gaudencio González Garza, del Instituto Mexicano del Seguro Social.* 3Dosta-Herrera Juan José, Médico Anestesiólogo y profesor titular del curso de anestesiología pediátrica, Jefe del servicio de anestesiología, Centro Médico Nacional Dr. Gaudencio González Garza, del Instituto Mexicano del Seguro social. CDMX.
Anestesia en México 2024;36(2):
Fecha de recepción abril 2024, fecha de revisión abril 2024, fecha de publicación mayo 2024 Jenny.hl@hotmail.com
Los linfangiomas (LFG) de cuello son malformaciones congénitas benignas, poco frecuentes, que se presentan generalmente durante la infancia. Su resección completa continúa siendo el tratamiento de elección, sin embargo; se puede usar la escleroterapia como tratamiento alternativo. El principal reto para el anestesiólogo lo representa el manejo de la vía aérea (VA) de estos pacientes.
Presentamos el caso de un paciente de 25 días de vida con el diagnóstico de LFG gigante de cuello, programado para su resección quirúrgica. Anestesia general balanceada. Se realiza el abordaje de la VA con ventilación espontánea, manteniendo al paciente en adecuado plano anestésico con halogenado y opioide de acción ultracorta, se realizó un primer intento de intubación con videolaringoscopio, sin embargo, al evidenciarse alteración en la anatomía de
Palabras clave: linfangioma de cuello, vía aérea difícil pediátrica, fibrobroncoscopio.
Abstract
Neck lymphangiomas are rare, benign congenital malformations that generally present during childhood. Its complete resection continues to be the treatment of choice, however; sclerotherapy can be used as an
alternative treatment. The main challenge for the anesthesiologist is represented by the management of the airway in these patients.
We present the case of a 25-day-old patient diagnosed with giant neck lymphangioma scheduled for surgical resection. The anesthetic plan was: Balanced general anesthesia. The airway was approached with spontaneous ventilation, keeping the patient in an adequate anesthetic plane with halogenated and ultra-short-acting opioids. A first intubation attempt was made with videolaryngoscope, however, when an alteration in the airway anatomy was evidenced, a second attempt was made with a fiberoptic bronchoscope. The currently available difficult airway management algorithms have in common the recommendation to limit attempts to approach the airway regardless of the device used; the pediatric anesthesiologist must have a personalized anesthetic plan in order to avoid complications derived from its management.
Keywords: neck lymphangioma, difficult pediatric airway, fiberoptic bronchoscope.
Introducción
El acto de asegurar la VA pacientes pediátricos es un elemento crucial de la atención en el entorno perioperatorio (1). Este grupo de pacientes puede presentar un amplio espectro de patología, tanto congénita como adquirida, que pueden alterar la anatomía de la VA, dificultando la intubación o ventilación. Para optimizar el manejo de una VAD, es importante comprender las diferencias anatómicas y fisiológicas de la VA pediátrica, así como familiarizarse con las enfermedades y síndromes que comúnmente la afectan (2).
La mayoría de los niños con VAD pueden identificarse obteniendo una historia clínica detallada y realizando una exploración física minuciosa. El manejo exitoso de la VAD pediátrica, tanto anticipada como no anticipada, se ve facilitado por la evaluación y preparación previas al procedimiento (1).
Caso clínico
Neonato de 25 días de vida, con diagnóstico de LFG gigante de cuello a cargo del servicio de cirugía oncológica pediátrica, programado para resección de tumor linfático cervical, traqueostomía, gastrostomía y broncoscopia. Se realizó interrogatorio directo a la madre, con los siguientes antecedentes de importancia: Heredofamiliares: sin relevancia para el padecimiento actual. Antecedentes prenatales: Producto de la 4a gestación, ingesta de hematínicos desde el diagnóstico de embarazo, adecuado control prenatal: 12 consultas. Seis ultrasonidos (USG)
A la exploración física: peso: 3500 gr, talla: 49 cm, macroglosia que abarca totalidad de la cavidad oral (Figura 1 y 2), sonda orogástrica a derivaciónn, micrognatia, cuello con aumento de volumen secundario a presencia de tumor, de bordes irregulares, consistencia blanda, no doloroso a la palpación, que se extiende hacia tórax anterior y miembro torácico derecho.
Figura 1. Linfagioma de cuello gigante Con aumento de volumen en cuello
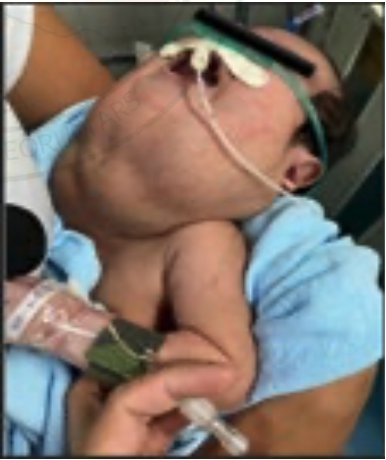
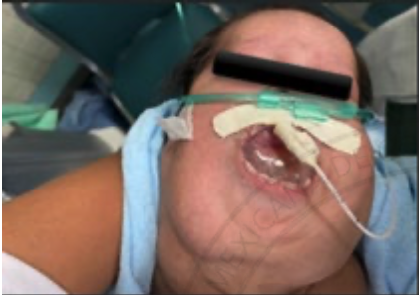
TC de cráneo y cuello (simple y contrastada): A nivel de cuello se identifica masa localizada desde la base de la lengua con extensión hasta el mediastino superior (Figura 3), dicha lesión con bordes circunscritos, multilobulada, hipodensa, la cual envuelve los vasos carotídeos. Extensión de la lesión hacia la parte anterior del hombro derecho y parte anterior de tórax, con tabiques finos, la cual no presenta realce a la administración de medio de contraste. Conclusión: Datos en relación a LFG a nivel de cuello.
Figura 3: TC que muestra lesión de bordes Circunscritos a nivel de cuello con extensión a mediastino superior.
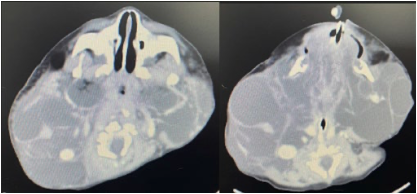
Plan anestésico
El día previo al procedimiento quirúrgico se acude a realizar valoración preanestésica, en la cual se determina la presencia de una VAD anticipada, se solicita contar con estudio de imagen de nuestra unidad y ante los hallazgos a la exploración se solicitó contar con mascarillas faciales, diferentes hojas de laringoscopio, cánulas orotraqueales, cánulas de orofaríngeas y guías para cánula orotraqueal, así como videolaringoscopio, fibrobroncoscopio neonatal y preparación de equipo para acceso quirúrgico de vía aérea de urgencia.
Sin embargo, por la localización anatómica del tumor, se advierte la posibilidad de no poder realizar intubación orotraqueal y traqueostomía de urgencia.
Ingresa paciente con vía periférica calibre 24G y catéter largo en miembro torácico izquierdo. Se inició monitoreo no invasivo y se obtienen los siguientes signos vitales: Tensión arterial (TA) 91/54 mm Hg, Frecuencia cardiaca (FC) 155 lpm, Saturación periférica de oxígeno (SpO2) 98 %. Se inició inducción inhalatoria con sevoflurano 3 vol % y posteriormente se inició perfusión de remifentanilo a concentración plasmática de 3-5 ng/mL, se colocó cánula orofaríngea, manteniendo ventilación espontánea, se manejó e instrumento la VA en posición lateral derecha para evitar compresión de estructuras por el tumor, realizándose laringoscopia indirecta con videolaringoscopio Glidescope Hoja 1, observándose con dificultad el espacio glótico, debido a alteración de la anatomía de la VA, por lo que se decide intubación orotraqueal en un segundo intento con fibrobroncoscopio neonatal, con cánula orotraqueal Número 3.5 de Murphy, sin globo, se corrobora adecuada situación de cánula orotraqueal mediante auscultación de ambos campos pulmonares, presencia de curva de capnografía positiva y continua y capnometría, se fija a 10 cm de comisura labial. Catéter venoso central femoral derecho por venodisección. Ventilación mecánica controlada por presión: (P inspiratoria) 9-12 cm H2O, FR 40-55 rpm, RIE: 1:1.5, PEEP 5 cm H2O y sevoflurano a CAM 1.1-1.2. Perfusión de remifentanilo para un concentración plasmática de 3-5 ng/mL. Perfusión de dexmedetomidina 0.3 μg/kg/h. Balance total: positivo 12 mL. Paracetamol 30 mg iv, Cefotaxima 100 mg, dexametasona 0.5 mg, Buprenorfina 12 μg iv fraccionados en dos bolos, metamizol 30 mg iv.
Discusión
Los LFG son malformaciones congénitas del sistema linfático y consisten en canales y quistes linfáticos de tamaño variable. La cabeza y el cuello son las regiones más frecuentemente afectadas, pero pueden localizarse
en cualquier parte del cuerpo (3). Los LFG pueden ser macroquísticos, con una pared gruesa y generalmente no se infiltran a otras estructuras adyacentes, o microquísticos, que generalmente infiltran la orofaringe, la nasofaringe, la hipofaringe y la lengua. Se pueden encontrar a cualquier edad de la vida; aproximadamente el 50 % están presentes al nacer y el 90 % se diagnostican antes de los dos años de edad (4). Dependiendo de su tamaño, profundidad y extensión de la fibrosis adyacente, pueden ser asintomáticos o provocar obstrucción de las vías respiratorias, disfagia, alteraciones en la fonación y problemas estéticos (5). El manejo de la VA de los pacientes que serán sometidos a un procedimiento quirúrgico con esta patología representan un reto para el anestesiólogo pediatra.
Es de importancia resaltar que la principal causa de morbimortalidad en anestesia pediátrica son los eventos adversos respiratorios, que se colocan como la segunda causa de parada cardiorrespiratoria perioperatoria en el niño (6,7).
Es por ello que el examen y la evaluación de la VA sigue siendo un componente fundamental del examen físico realizado durante la evaluación preoperatoria y preanestésica, ya que su objetivo es identificar aquellos pacientes en los que el manejo de la VA puede ser problemático (8). Aunque un alto porcentaje de dificultades con el manejo de la VA se encuentran en pacientes con síndromes clínicos específicos, pueden surgir problemas con el niño aparentemente sano sin antecedentes médicos (9).
Es responsabilidad del anestesiólogo pediatra elaborar un plan anestésico que incluya una estrategia de manejo de la VA definiendo quién, cómo y dónde se desarrollará su abordaje, dicha estrategia deberá adecuarse e individualizarse a cada paciente y a cada centro médico. Los algoritmos diseñados y dirigidos al paciente pediátrico por las diferentes sociedades como: Polish Society, Société Francaise d’Anesthésie et de Réanimation (SFAR), All India Difficult Airway Association (AIDAA) y la Difficult Airway Society (DAS), ofrecen estrategias para el manejo de la VA inesperadam (8,10). Específicamente la DAS cuenta con tres algoritmos para el manejo de la VA inesperada en pacientes pediátricos de uno a ocho años, el primero hace referencia a la dificultad para la ventilación durante la inducción anestésica, el segundo a la dificultad para la intubación orotraqueal y el último a un escenario de un paciente que no se puede ventilar ni intubar. En general los algoritmos tienen en común la recomendación de limitar los intentos en el abordaje de la VA independientemente del dispositivo empleado.
En el caso del paciente nos situamos inmediatamente en el segundo algoritmo de la DAS, ya que el paciente mantuvo ventilación espontánea con el uso de una cánula orofaríngea, por lo que se decidió realizar la primer laringoscopia con un videolaringoscopio, sin embargo no se observó el espacio glótico por la anatomía alterada, ante esta situación y con la infiltración del LFG a la base de la lengua el hecho de pensar en colocar un dispositivo suplaglótico no era opción aunado al tipo de cirugía a realizar en la cual era obligatorio la intubación orotraqueal, por este motivo se decide abordar con fibrobroncoscopio. Una segunda opción que se consideró en la traqueostomía previa a la cirugía, independientemente que esta podría ser complicada para el cirujano, por la infiltración del LFG en cuello, sin embargo, es preferible una traqueostomía programada a una de urgencia en donde todo puede complicarse rápidamente.
En conclusión, el manejo anestésico del paciente pediátrico con VAD prevista se debe llevar a cabo por personal experto, con material específico y en un hospital de tercer nivel, independientemente del procedimiento o intervención a realizar. En casos complejos, la combinación de técnicas, como el uso de videolaringoscopio más fibrobroncoscopio o el uso de dispositivos supraglóticos más fibrobroncoscopio tienen la ventaja de minimizar los riesgos y sumar los beneficios de cada una de ellas, la elección de éstas depende de la situación clínica del paciente, de la experiencia del operador y de la disponibilidad de los dispositivos (8).
Referencias
1. Krishna SG, Bryant JF, Tobias JD. Management of the diffi- cult airway in the pediatric patient. J Pediatr Intensive Care [Internet]. 2018;7(3):115–25. Available from: http://dx.doi. org/10.1055/s-0038-1624576
2. Figueroa-Uribe F, Flores-del Razo JO, Vega-Rangel V, Mén- dez-Trejo V, Ferrer-López M, González-Chávez NA. Escalas predictoras para identificar vía aérea difícil en población pediátrica: su utilidad en el servicio de urgencias. Rev Mex Pediatr [Internet]. 2019;86(4):162–4. Available from: http://dx.doi.org/10.35366/sp194h
3. Okazaki T, Iwatani S, Yanai T, Kobayashi H, Kato Y, Marusasa T, et al. Treatment of lymphangioma in children: our experi- ence of 128 cases. J Pediatr Surg [Internet]. 2007;42(2):386– 9. Available from: http://dx.doi.org/10.1016/j.jped- surg.2006.10.012
4. Zhou Q, Zheng JW, Mai HM, Luo QF, Fan XD, Su LX, et al. Treatment guidelines of lymphatic malformations of the head and neck. Oral Oncol [Internet]. 2011;47(12):1105–9. Available from: http://dx.doi.org/10.1016/j.oraloncolo-
5. Benazzou S, Boulaadas M, Essakalli L. Giant pediatric cer-
vicofacial lymphatic malformations. J Craniofac Surg [In- ternet]. 2013;24(4):1307–9. Available from: http://dx.doi. org/10.1097/SCS.0b013e3182942b8f
6. de Graaff JC, Bijker JB, Kappen TH, van Wolfswinkel L, Zuithoff NPA, Kalkman CJ. Incidence of intraoperative hy- poxemia in children in relation to age. Anesth Analg [Inter- net]. 2013;117(1):169–75. Available from: http://dx.doi. org/10.1213/ANE.0b013e31829332b5
7. Cook TM, Woodall N, Frerk C. Major complications of air- way management in the UK: results of the Fourth National Audit Project of the Royal College of Anaesthetists and the Difficult Airway Society. Part 1: Anaesthesia. Br J Anaesth [Internet]. 2011;106(5):617–31. Available from: http://dx. doi.org/10.1093/bja/aer058
8. Schmucker Agudelo E, Farré Pinilla M, Andreu Riobel- lo E, Franco Castanys T, Villaverde Castillo I, Monclus Diaz E, et al. Actualización en el manejo de la vía aérea difícil en pediatría. Rev Esp Anestesiol Reanim [Inter- net]. 2022;69(8):472–86. Available from: http://dx.doi. org/10.1016/j.redar.2021.05.012
9. Weiss M, Engelhardt T. Proposal for the management of the unexpected difficult pediatric airway. Paediatr Anaesth [Internet]. 2010;20(5):454–64. Available from: http://dx. doi.org/10.1111/j.1460-9592.2010.03284.x
10. Pawar DK, Doctor JR, Raveendra US, Ramesh S, Shetty SR, Divatia JV, et al. All India Difficult Airway Association 2016 guidelines for the management of unanticipated difficult tracheal intubation in Paediatrics. Indian J Anaesth [Inter- net]. 2016;60(12):906–14. Available from: http://dx.doi. org/10.4103/0019-5049.195483
Persistent Areactive Mydriasis Due to the Use of Neuromuscular Blockers: Case Report
1Alondra Velázquez-Pillado. Médico residente de la especialidad de Anestesiología Hospital Regional General Ignacio Zaragoza ISSSTE. 2Kenia Olvera-Guerrero. Médico residente de la especialidad de Anestesiología Hospital Regional General Ignacio Zaragoza ISSSTE 3Aviña Pérez Diego. Anestesiólogo adscrito de Hospital Regional General Ignacio Zaragoza ISSSTE. Ciudad de México
Anestesia en México 2024;36(2):
Fecha de recepción noviembre 2023, Fecha de revisión febrero 2024, Fecha de publicación mayo 2024 alo2929295@gmail.com
Resumen.
l bromuro de vecuronio es un bloqueador neuromuscular (BNM) no despolarizante de uso común durante la anestesia general para facilitar la intubación traqueal, para ayudar en la relajación quirúrgica y, con menos frecuencia, en el entorno de cuidados intensivos para lograr la parálisis para facilitar la ventilación mecánica para pacientes adecuadamente sedados. Presentamos el caso de una mujer de 39 años de edad que fue sometida a una exenteración pélvica bajo anestesia general balanceada con uso de vecuronio como bloqueador neuromuscular, que presentó midriasis arreactiva bilateral durante el transanestésico que se resolvió con la administración de sugammadex.
Palabras clave: bromuro de vecuronio, midriasis arreactiva
Abstract
Vecuronium bromide is a nondepolarizing neuromuscular blocker commonly used during general anesthesia to facilitate endotracheal intubation, to aid in surgical
Keywords: vecuronium bromide, areactive mydriasis
Introducción
El bromuro de vecuronio es un bloqueador neuromuscular no despolarizante, esteroide monocuartenario, de acción periférica, aprobado por la Administración de Alimentos y Medicamentos (FDA), con una duración de acción intermedia que carece de efectos cardiovasculares, se usa durante la anestesia general para facilitar la intubación traqueal, para ayudar en la relajación quirúrgica y, con menos frecuencia, en el entorno de cuidados intensivos para lograr la parálisis para facilitar la ventilación mecánica
El vecuronio es un agente que logra la parálisis del músculo esquelético al competir con la acetilcolina por los sitios de los receptores colinérgicos y al unirse con el receptor colinérgico nicotínico en la membrana postsináptica de la placa terminal motora. (1)
Cuando un paciente está bajo anestesia balanceada, el tiempo para recuperar el 25 % del control es de aproximadamente 25 a 40 minutos. La recuperación suele completarse en un 95 % entre 45 y 65 minutos después de la dosis de intubación. La presencia de anestésicos halogenados volátiles como el sevoflurano o el desflurano potencia ligeramente la acción bloqueante neuromuscular del vecuronio (1).
El evento adverso primario asociado con todos los agentes neuromusculares no despolarizantes es la extensión del efecto farmacológico del fármaco más allá del tiempo necesario de uso, lo que resulta en efectos adversos que van desde debilidad del músculo esquelético hasta parálisis muscular prolongada que conduce a insuficiencia respiratoria o apnea. Las anomalías electrolíticas, como hipocalcemia grave, hipopotasemia o hipomagnesemia, pueden potenciar los efectos del vecuronio. (1)
Una cuantificación del bloqueo neuromuscular es esencial para todas las etapas de la anestesia cuando se utiliza BNM. Incluso si los agentes de reversión de anticolinesterasa se usan de forma rutinaria, la incidencia de bloqueo residual es alta: 20-40 %. El índice TOF (por sus siglas en inglés, train of four) actual al que se recomienda la extubación es superior a 0,9 (2).
El monitoreo neuromuscular también es útil para elegir la estrategia antagonista. Cuando se utilizan anticolinesterásicos o sugammadex, la elección del agente de reversión debe guiarse por la monitorización neuromuscular. La dosis de antagonismo y el tiempo de inyección también pueden optimizarse mediante el control adecuado de la profundidad del bloqueo neuromuscular (2).
Los efectos del vecuronio son reversibles con una ciclodextrina modificada que encapsula el compuesto, lo que reduce la cantidad de fármaco disponible para unirse a los receptores colinérgicos nicotínicos. También las anticolinesterasas antagonizan las propiedades bloqueantes neuromusculares del vecuronio (1).
Las recomendaciones actuales sugieren que, en caso de bloqueo neuromuscular profundo (TOF 0), se deben evitar los inhibidores de la acetilcolinesterasa y utilizar sugammadex (4-16 mg/kg); en el bloqueo moderado (TOF 01-0.4). (2 mg/ kg) como antagonistas de la acetilcolinesterasa (0,07 mg/ kg de neostigmina), y para la reversibilidad del bloqueo
La anestesia general es una afección reversible inducida por fármacos que incluye rasgos conductuales y fisiológicos específicos (inconsciencia, amnesia, analgesia y acinesia) con la estabilidad concomitante de los sistemas autonómica, cardiovascular, respiratoria y termorregulado (3).
La anestesia general produce patrones distintivos en el electroencefalograma (EEG), el más común de los cuales es un aumento progresivo en la actividad de baja frecuencia y alta amplitud a medida que se profundiza el nivel de la anestesia general (3).
El hecho de que la anestesia general pueda ser funcionalmente equivalente a la muerte del tronco encefálico indica que tan profundamente la anestesia general puede deprimir la función cerebral y quizás explica por qué algunos pacientes no recuperan completamente la conciencia durante varias horas después de la anestesia general y por qué la disfunción cognitiva posoperatoria podría persistir en pacientes de edad avanzada durante varios meses (3).
El principal objetivo de la neuromonitorización consiste en detectar, para intentar evitar o reducir, la lesión cerebral secundaria, representada en la hipoxia e isquemia cerebral, la disfunción metabólica, la hipertensión endocraneal y la aparición de actividad comicial. El logro de este objetivo pasará por asegurar un adecuado aporte de oxígeno y sustrato metabólico al cerebro (4).
Se ha demostrado que la administración a corto plazo de agentes bloqueadores neuromusculares no tiene efecto sobre el tamaño de la pupila en pacientes anestesiados sanos (5).
El diámetro pupilar en reposo representa un equilibrio entre los dos sistemas: la estimulación del Sistema Nervioso Autónomo Simpático (SNS) dilata la pupila, y la estimulación del Sistema Nervioso Autónomo Parasimpático (SNP) la contrae. Por lo tanto, la activación del SNS o la inhibición del SNP provocan midriasis (5).
En cuanto al equilibrio autonómico del reflejo pupilar, los agentes bloqueadores neuromusculares parecen inhibir preferentemente la transmisión colinérgica, provocando midriasis (5).
La barrera hematoencefálica (BHE) está formada por células endoteliales micro vasculares que recubren los capilares cerebrales que penetran en el cerebro y la médula espinal. La barrera hematoencefálica está desempeñando un papel fundamental en la protección del parénquima cerebral de los agentes transmitidos por la sangre y proporciona un obstáculo importante para la entrada de fármacos y otros compuestos exógenos en el
Las pupilas dilatadas y no reactivas no se han informado como una reacción adversa de la administración de agentes bloqueadores neuromusculares, ya que se caracterizan por una baja lipófila, lo que las hace incapaces de superar la barrera hematoencefálica (7).
Además de que el vecuronio tiene un peso molecular de 637 Da, superando el límite de permeabilidad normal de la barrera hematoencefálica (11).
Los bloqueadores neuromusculares no despolarizantes no cruzan la barrera hematoencefálica, pero en caso de desregulación de esta y altas concentraciones de estos agentes podrían inducir efectos centrales. (7).
Se han informado pupilas dilatadas no reactivas secundarias a la administración de bloqueadores neuromusculares en pacientes con sepsis y se atribuyen a la ruptura de la barrera hematoencefálica debido al intenso estado inflamatorio. También hay un informe de un recién nacido (10 días de vida) que tuvo pupilas dilatadas no reactivas secundarias al uso de bloqueadores neuromusculares, lo que se atribuyó a la inmadurez de la barrera hematoencefálica (8).
Los estudios han informado que la infusión a largo plazo de agentes de bloqueo neuromuscular causa pupilas dilatadas invertidas. Schmidt informó que la infusión de atracurio o vecuronio provocó pupilas dilatadas y no reactivas en 3 pacientes adolescentes con síndrome de distrés respiratorio agudo (9).
También se ha notificado midriasis fija en pacientes con síndrome de distrés respiratorio agudo sometidos a terapia de oxigenación por membrana extracorpórea (ECMO) con infusión continua de rocuronio. (11)
Además, también deben descartarse causas como la inhibición farmacológica del SNP (es decir, con atropina), actividad simpática excesiva (sobredosis de simpaticomiméticos o altas dosis de aminas vasoactivas), hipotermia, sobredosis de barbitúricos e hipermagnesemia (11).
Cuando el agente es anticolinérgico, la pupila a menudo se dilata y no se contrae a la luz. Por el contrario, los fármacos simpaticomiméticos rara vez dilatan la pupila más de 1 o 2 milímetros. La midriasis farmacológica no se asocia con dolor, ptosis o diplopía (10).
La midriasis farmacológica se puede confirmar al demostrar una constricción parcial o nula después de la
aplicación de un colirio de pilocarpina al 1 % (10).
La hipovolemia hemorrágica aguda provoca activación
simpática. La hiperactivación del sistema simpático podría, en teoría, causar pupilas dilatadas (11).
Aunque el resultado final de la hipovolemia e hipoperfusión severas es un daño cerebral irreversible, en etapas tempranas, las pupilas dilatadas pueden ser un signo de hiperactivación simpática o hipoperfusión (11).
Presentación de caso
Paciente femenino de 39 años de edad con diagnóstico de adenocarcinoma de recto a quien se realiza Laparotomía exploradora más exenteración total bajo anestesia general balanceada.
Antecedentes de importancia transfusiones de concentrados eritrocitarios y plasma fresco congelado por sangrado de tubo digestivo bajo y anemia severa. Laboratorios previos a intervención con Hemoglobina: 9, Hematocrito: 28.2, Plaquetas: 483,000, TP: 15.6, INR: 1.4, TPT: 27.5, Glucosa: 85, Urea 15, Creatinina: 0.90, sodio: 131, potasio: 2.8, cloro: 109, resto sin alteraciones. Gasometría arterial con acidosis metabólica no compensada. Antecedentes anestésicos de dos cesáreas bajo anestesia neuroaxial, colonoscopia bajo sedación sin complicaciones. Toxicomanías interrogadas y negadas. Peso: 59 Kg, Talla: 1.67 metros.
Debido a la contraindicación para anestesia combinada por tiempos de coagulación prolongados se decide brindar solo anestesia general balanceada.
Se recibe en sala asignada, se procede a monitorización hemodinámica no invasiva e invasiva con Tensión arterial (TA): 112/63 mm Hg, Presión arterial media (PAM): 77 mm Hg, Frecuencia cardiaca (FC): 120 latidos por minuto (lpm), frecuencia respiratoria (FR): 20 respiraciones por minuto (rpm), saturación periférica de oxígeno (SatO2): 94 % al aire ambiente. Se coloca Índice biespectral (BIS) con valor inicial de 98, se pre oxigena con mascarilla facial a 6 litros por minuto durante 6 minutos, se realiza inducción Intravenosa a base de fentanilo 200 μg intravenoso, lidocaína 100 mg intravenoso, vecuronio 6 mg intravenoso, propofol 100 mg intravenoso.
Se realizó intubación traqueal exitosa. Se intentó tomar línea arterial en cuatro ocasiones en ambas arterias radiales, sin éxito por fragilidad capilar. Acidosis metabólica por lo que se hace reposición de bicarbonato, gluconato de calcio, potasio y líquidos con adecuada respuesta.
Se administró 2 mg más de vecuronio. Infusión de fentanilo de 2-2.5 μg/kg/h, infusión de lidocaína a 2 mg/ kg/h y sevoflurano, CAM promedio 0.8-0.9. Manteniendo Índice biespectral entre 45-55.
Adyuvantes: hidrocortisona 100 mg, omeprazol 40 mg, clonixinato de lisina 100 mg, sulfato de Mg 1.5 gramos, paracetamol un gramo, ácido ascórbico 1 gramo, metronidazol 500 mg, gluconato de Calcio 4 gramos,
Transcurridas 4:30 horas de iniciado el procedimiento y control adecuado de sangrado y efectiva reanimación hídrica se revisan conjuntivas encontrándose pálidas, con pupilas mióticas, simétricas. Sin posibilidad de cuantificar diuresis por sección de uréteres como parte de técnica quirúrgica. Treinta minutos después se observa caída de valor de Índice biespectral a 35, sin ningún cambio hemodinámico en constantes vitales ni EtCO2, por lo que se revisan pupilas nuevamente encontrándose midriáticas de aproximadamente 7 mm, simétricas sin respuesta a estímulo luminoso. Se decidió bajar a la dosis de infusión de Fentanilo, se suspende lidocaína y se baja CAM de sevoflurano a 0.5- 0.6 sin mejoría de valor de Índice biespectral persistiendo de 30-35, pupilas sin cambio alguno.
Se notifica a médico tratante. Iniciando con cierre de piel de herida se suspende fentanilo y se cierra a Sevoflurano. Una hora después termina el procedimiento quirúrgico y se solicita Tomografía computarizada de cráneo para descartar hemorragia subaracnoidea. Previo a realizar TAC con Índice biespectral de 77 sin respuesta pupilar. Se traslada a Unidad de Cuidados Postanestésicos con apoyo vasopresor a dosis mínima, con apoyo mecánico ventilatorio por ausencia de esfuerzo respiratorio. La TAC de cráneo no mostró cambios agudos en el sistema nervioso central (SNC).
Figura 1: Pupila dilatada no reactiva tras la administración de vecuronio
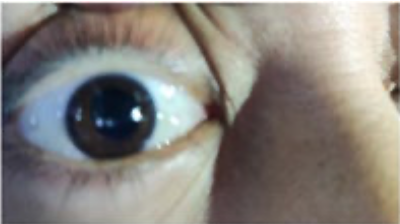
Dos minutos posteriores a la administración del fármaco el paciente presento miosis de pupilas de tres mm, simétricas con adecuada respuesta a estimulo luminoso, movimientos de extremidades plenos, con adecuado esfuerzo respiratorio por lo que se decidió retirar el tubo traqueal de la paciente. Se suspende apoyo vasopresor. Se interrogo a paciente y refiere que mientras tenía el tubo en la tráquea, ella entendía todo lo que se le preguntaba. No presentó alguna molestia con una adecuada agudeza visual.
Figura 2: Pupilas reactivas tras la reversión neuromuscular
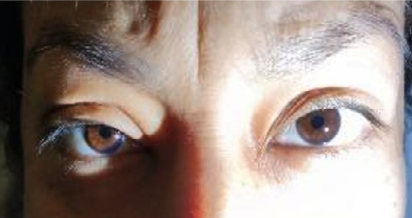
Discusión
Presentamos el caso de una mujer con midriasis arreactiva bilateral, posterior al uso de una dosis de vecuronio, con anestesia general balanceada, con duración de seis horas de duración, acompañado de choque hipovolémico y uso de vasopresores a base de norepinefrina, para mantener presión arterial media normal. Midriasis, que se resolvió con la administración de sugammadex.
La literatura no revelo que el vecuronio tenga efecto sobre el tamaño pupilar. El bromuro de Vecuronio es un bloqueador neuromuscular no despolarizante, esteroide monocuartenario, de acción periférica, con una duración de acción intermedia, que carece de efectos cardiovasculares, se usa durante la anestesia general. Logra la parálisis del músculo esquelético al competir con la acetilcolina por los sitios de los receptores colinérgicos y al unirse con el receptor colinérgico nicotínico, en la membrana postsináptica de la placa terminal motora.
El evento adverso primario asociado con todos los agentes neuromusculares no despolarizantes, es la extensión del efecto farmacológico del fármaco, más allá del tiempo necesario de uso. La recuperación suele completarse en un 95 %, entre 45 y 65 minutos, después de la dosis de intubación, sin embargo, se ha informado que el uso de BNM en infusión, durante varios días provoca midriasis arreactiva. La prueba de pilocarpina es un método simple y confiable utilizado para distinguir la midriasis farmacológica de la neurológica, descartada por un adecuado monitoreo neurológico y estudios de imagen. Desafortunadamente, no se sometió a nuestra paciente a la prueba cuando su pupila estaba dilatada, momento en el que sospechamos que la prueba habría sido positiva.
Las pupilas dilatadas no se han informado como una reacción adversa de la administración de bloqueadores neuromusculares, ya que se caracterizan por una baja lipófila, lo que las hace incapaces de atravesar la barrera hematoencefálica. Además de que el vecuronio tiene un peso molecular de 637 Da, superando el límite de permeabilidad normal de la BHE, sin embargo, se han presentado casos de pacientes críticamente enfermos, los cuales han sufrido una alteración de la permeabilidad de la barrera hematoencefálica, así como altas concentraciones de bloqueadores neuromusculares, que podrían inducir efectos centrales, produciendo midriasis arreactiva, la cual se revertió con la interrupción de la administración del bloqueador neuromuscular.
Nuestra hipótesis en primer lugar, es que los cambios en la barrera hematoencefálica inducidos por el estrés inflamatorio y oxidativo relacionado con el cáncer, la infección, la respuesta metabólica al trauma y el choque hipovolémico, con degradación del glucocalix, permitieron la acción del vecuronio sobre los receptores nicotínicos en el SNC, y alteraron la transducción de señales colinérgicas, lo que resultó en la midriasis paralítica, descartando otras causas por la respuesta pupilar inmediata y favorable a la administración de sugammadex.
En segundo lugar, un aumento de su biodisponibilidad farmacológica por una probable falla renal aguda secundaria a choque hipovolémico lo que provocó una eliminación más prolongada del fármaco. Desafortunadamente no se pudo cuantificar diuresis por la técnica del procedimiento quirúrgico.
Los estudios de imagen descartaron cualquier daño cerebral agudo y estructural.
Conclusión
La midriasis arreactiva por vecuronio es infrecuente, pero constituye un evento de especial interés, ya que se tiene que hacer un diagnóstico diferencial, entre un daño cerebral irreversible y otras causas de midriasis
farmacológica. Por lo que es importante siempre mantener una vigilancia estrecha mediante neuromonitoreo y monitoreo neuromuscular, en cualquier anestesia general, que permita identificar de manera temprana las posibles causas de la midriasis y determinar la conducta a seguir.
Referencias
1. Ramzy M, McAllister RK. Vecuronium [Internet]. Treasure Island (FL): StatPearls; 2022; [revisado 26 dic 2022; consul- tado 29 jun 2023]. Disponible en: https://www.ncbi.nlm. nih.gov/books/NBK493143/
2. Duţu M, Ivaşcu R, Tudorache O, Morlova D, Stanca A, Ne- goiţă S, Corneci D. Neuromuscular monitoring: an update. Rom J Anaesth Intensive Care. 2018 Apr;25(1):55-60. DOI: 10.21454/rjaic.7518.251.nrm
3. Brown EN, Lydic R, Schiff ND. General anesthesia, sleep, and coma. N Engl J Med. 2010 Dec 30;363(27):2638-50. DOI: 10.1056/NEJMra0808281
4. Domínguez-Berrot AM, González-Vaquero M, Díaz-Domín- guez FJ, Robla-Costales J. Neuromonitorización multimodal en el TCE: aportación de la PTiO2. Med Intensiva. 2014 Nov;38(8):513–21. DOI: 10.1016/j.medin.2014.02.005
5. Fernandes FA, Pontes JPJ, Borges CER, Honorato EL, Soares SD, Módolo NSP, Lima LHNE. Non-reactive mydriasis after rocuronium infusion in patients with COVID-19: a case se- ries. Braz J Anesthesiol. 2022. Nov-Dec;72(6):829-831. DOI: 10.1016/j.bjane.2022.05.007
6. Pardridge WM. Drug transport across the blood-brain ba- rrier. J Cereb Blood Flow Metab. 2012. Nov;32(11):1959- 72. DOI: 10.1038/jcbfm.2012.126
7. Zakynthinos GE, Tsolaki V, Bardaka F, Makris D. Fixed dila- ted pupils in Covid-19 ARDS patients under rocuronium, re- versed after discontinuation. J Crit Care. 2021. Oct;65:259- 260. DOI: 10.1016/j.jcrc.2021.07.005
8. Rodrigues EDP, da Costa GC, Braga DQ, Pinto JEDSS, Les- sa MA. Rocuronium-Induced Dilated Nonreactive Pupils in a Patient With Coronavirus Disease 2019: A case re- port. A Pract. 2021. Jun 24;15(7):e01491. DOI: 10.1213/ XAA.0000000000001491
9. He H, Yu Z, Zhang J, Cheng W, Long Y, Zhou X, Yuan S.. Bila- teral dilated nonreactive pupils secondary to rocuronium infusion in an ARDS patient treated with ECMO therapy: A case report: A case report. Medicine (Baltimore). 2020. Aug 21;99(34):e21819. DOI: 10.1097/MD.0000000000021819
10. KedarS,BiousseV.Approachtothepatientwithanisocoria. UpToDate [Internet]. 2021 [citado el 1 de julio de 2023]. Disponible en https://www.uptodate.com
11. FattahiA,DaneshiA.Bilateralreactiveandthenfixedmydria- sis as a marker of hypovolemic shock. Br J Neurosurg. 2020. Apr;34(2):235. DOI: 10.1080/02688697.2020.1718602
Manejo Anestésico del Síndrome de Susac.
Anesthetic Management Susac’s Syndrome
Mariana Paz-Rossainz*, J Ramón-Flores**, Enrique Hernández-Cortéz***, Miguel-Magaña*, Yolanda Martina Martínez- Barragán***
*Residente de anestesiología del Hospital Universitario de Puebla. **Departamento de Anestesiología Hospital Universitario de Puebla. Hospital Universitario de Puebla. *** Dr. Enrique Hernández Cortéz expresidente de la FMCAAC. Anestesiólogo pediatra. ***Dra. Yolanda Martina Martínez Barragán. Benemérita Universidad Autónoma de Puebla.
Anestesia en México 2024;36(2):
Fecha de recepción marzo 2024. Fecha de revisión marzo 2024. Fecha de publicación mayo 2024 yolanda.martinez@correo.buap.mx
Resumen.
El Síndrome de Susac es una enfermedad inusual, con pocos casos descritos en la literatura. Su origen inmunológico explica el daño en la microvasculatura de las leptomeninges cerebral, retinal y timpánica; el síntoma dominante es cefalea de moderada- intensa, secundario a hipertensión intracraneal, seguida de hipoacusia neurosensorial y cambios en la visión. Caso clínico: Se presenta el caso de paciente femenino de 57 años, con síndrome de Susec, programada para osteosíntesis de meseta tibial, que ingreso a quirófano, con hipertensión intracraneal leve, detectada por el diámetro de la vaina del nervio óptico, mediante ultrasonografía, manejada bajo anestesia neuroaxial, sin complicaciones. Conclusión: El síndrome de Susac es una enfermedad poco conocida por los anestesiólogos, por lo que representa un reto su manejo. Sustentado en la escasa literatura existente, se considera que el abordaje anestésico, debe estar guiado
Palabras Clave: Síndrome de Susac, hipertensión intracraneal, anestesia neuroaxial.
Abstract
Susac ́s Syndrome is an unusual disease, with few cases described in the literature. Its immunological origin explains the damage to the microvasculature of the cerebral, retinal and tympanic leptomeninges; The dominant symptom is moderate-severe headache, secondary to intracranial hypertension, followed by sensorineural hearing loss and vision changes. Clinical case: The case of a 57-year- old female patient with Susec syndrome, scheduled for tibial plateau osteosynthesis, who was admitted to the operating room, with mild intracranial hypertension, detected by the diameter of the optic nerve sheath, by ultrasonography, is presented. managed under neuraxial
anesthesia, without complications. Conclusion: Susac syndrome is a disease little known by anesthesiologists, which is why its management represents a challenge. Based on the limited existing literature, it is considered that the anesthetic approach should be guided by the degree of intracranial hypertension and the type of surgery to be performed.
Keywords: Susac syndrome, intracranial hypertension, neuraxial anesthesia.
Introducción
El síndrome de Susac (SuS) también conocido como “SICRET” se debe a pequeños infartos del tejido coclear, retiniano y encefálico. Hasta este momento, se han descrito 400 – 500 casos, en la literatura desde su primera descripción. (Figura 1).
Este síndrome tiene un patrón autoinmunitario, con oclusión de pequeños vasos a nivel cerebral, oído interno y retina, responsables de la triada clínica: disfunción del sistema nervioso central (cefalea) (1,2) alteraciones visuales y perdida de la audición neurosensorial, estás son características de la enfermedad. Sin embargo, solo el 13-15 % de los pacientes con SuS presentan la triada completa.
Figura 1: Lesiones en sustancia gris y blanca en una porción del cuerpo callos. Conocidas como “bola de nieve o “rayos”
El curso de la enfermedad es variable pudiendo ser; “monocíclico” remisión a los 2- 4 años de la enfermedad, “Remitente-Recurrente” o “crónica-continua” por más de 4 años seguidos (7). Los criterios diagnósticos son de importancia, ya que cumplir la triada del compromiso cerebral, retiniano y vestibulococlear hace un diagnóstico definitivo, sin embargo, existen varias formas de presentación clínica ver Cuadro 1 (3).
El abordaje anestésico propuesto con el rastreo ultrasonográfico de la vaina del nervio óptico (8, 9) monitorizado de manera frecuente a lo largo del procedimiento anestésico, ante la negativa para una anestesia general, forma parte de una estrategia de atención perioperatoria (10).
El tratamiento médico, se basa en dosis altas de corticosteroides como base, más terapias adicionales de inmunoglobulinas, micofenolato, ciclofosfamida y rituxumab (1,2).
Fuente: Brain 2021; 145(3), 858-871.
Caso clínico
Mujer de 57 años, quien ingresa a urgencias presentando dolor y deformidad en miembro pélvico izquierdo, secundario a caída desde su propio plano de sustentación. Es valorada por el servicio de Traumatología con diagnóstico de fractura cerrada de meseta tibial izquierda y programada para reducción abierta, más fijación interna con colocación de placa anatómica.
Antecedentes relacionados con los criterios diagnósticos del síndrome Susac. En la valoración preanestésica se encuentra los siguientes antecedentes de importancia: síndrome de Susac diagnosticado seis meses previos a su internamiento, por los servicios de neurología, oftalmología y otorrinolaringología.
Caracterizado por cefaleas, pérdida de la visión e hipoacusia progresiva. Resonancia magnética con lesiones pequeñas redondeadas multifocales e hiperdensas. Signos de isquemia en la rama de la arteria retiniana y pérdida de la audición progresiva en seis meses hipoacusia importante. En tratamiento con ácido micofenolico 500 mg cada 24 horas y ácido acetil salicílico 100 mg cada 24 horas. Niega antecedentes de síndrome coronario agudo alergias y transfusionales. Infectocontagiosos: antecedente de Covid-19 leve en 2022 sin requerir hospitalización ni oxigeno suplementario. No cuenta con vacunación para SARS CoV2. Antecedentes quirúrgicos/anestésicos: colecistectomía abierta + choque Séptico bajo Anestesia General Balanceada, colangiopancreatografia retrógrada endoscópica y dos cesáreas bajo anestesia regional; todas sin complicaciones.
Los estudios de laboratorio dentro de parámetros normales, EKG: Ritmo sinusal, frecuencia cardiaca: 71
Se le asignan los siguientes riegos cardiovasculares Goldman II, Lee I, Detsky, ASA II, Caprini: alto, Ariscat: bajo.
Se decide anestesia neuroaxial peridural más bloqueo del canal de los aductores ante el rechazo del paciente para anestesia general.
A su ingreso a quirófano refiriendo cefalea frontal bilateral tipo opresiva de intensidad 5/10. Se inicia monitorización no invasiva y se registran los siguientes signos vitales: tensión arterial: 110/64 mm Hg, frecuencia cardiaca 66/ minuto, frecuencia respiratoria: 14/minuto, saturación de oxígeno: 98 %, se observa trazo electrocardiográfico normal.
Ante la presencia de la cefalea y el rechazo de la paciente de recibir anestesia general, decide realizar rastreo ultrasonográfico de la vaina del nervio óptico, para estimar la presencia de hipertensión intracraneal, encontrándose una medición de 5.7 mm en ojo derecho (OD) y 5.5 mm en ojo izquierdo (OI).
Se coloca a la paciente en posición decúbito lateral izquierdo, y con técnica estéril se procede a colocar bloqueo peridural a nivel de L2-L3 a continuación se administra dosis anestésica de lidocaína al 2 % con volumen de cinco mililitros alcanzando un nivel de T10. Se regresa paciente en decúbito supino y se interroga sobre aumento en la intensidad de cefalea y síntomas agregados como náusea, vómito, mareo, visión borrosa o tinitus, los cuales son negados por la paciente, se corroboran signos vitales estables y se realiza nuevamente rastreo del diámetro de la vaina del nervio óptico (DVNO) con una medición de 5.8 mm en OD y 5.6 en OI.
Se coloca pierna izquierda de la paciente en abducción y rotación externa con leve flexión de rodilla, se ubica punto medio entre cresta iliaca anterior superior y rodilla, mediante técnica estéril y utilizando transductor lineal se coloca bloqueo de canal de abductores izquierdo con ropivacaína al 0.75 % con un volumen de 15 mL para analgesia postquirúrgica. A 30 minutos del bloqueo peridural se inicia procedimiento quirúrgico. Mantenimiento: a los 45 minutos se descarta la ubicación intravascular del catéter peridural con tres mL de lidocaína/epinefrina sin cambios en signos vitales. Se continua anestesia peridural con bolos lidocaína al 2 % en bolos de 10 mL a los 50 minuto, 90 minuto y 120 minuto junto con monitorización de Presión cerebral intracraneal (PIC) por ultrasonografía del DVNO con valores máximos de 5.8 mm ojo derecho y 5.9 mm ojo izquierdo ambos sin grandes alteraciones durante transanestésico.
Con un tiempo total de tres horas 20 min de cirugía y cuatro horas de anestesia termina el procedimiento sin eventualidades.
Paciente pasa a área de cuidados post anestésicos con Bromage modificado: 1, Aldrete: 9 Ramsay: 2, Dolor: 0/10 en escala de ENA. Signos vitales: TA: 111/60 mm Hg, FC: 70 lpm, FR: 12 rpm, SatO2: 96 % a aire ambiente. Se retira catéter peridural integro al término del procedimiento. Se da seguimiento en piso a las 12 y 24 horas postquirúrgicas refiere diminución de la cefalea con escala ENA 3/10 la cual disminuye aún más tras administración de tramadol 50 mg, cada 12 horas y paracetamol un gramo cada ocho horas vía intravenosa, como esquema analgésico post operatorio indicado por servicio tratante
Discusión:
El Síndrome de Susac fue reportado en el año de 1976 por J.O Susac y una incidencia de 0.148/100,000 basado en la población europea.
Su fisiopatología aún no se comprende completamente, las hipótesis que se plantean con base a estudios postmortem y tomas de biopsia, sustenta su origen inmunitario con microangiopatía focal de pequeños vasos precapilares.
El síntoma más relevante es la cefalea presente en 80 %, de los pacientes con este diagnóstico, si bien este síntoma, no está específicamente relacionado con el síndrome y no forma parte de la triada diagnóstica, es un síntoma que indica daño neurológico, por inflamación y daño de vasos sanguíneos en las leptomeninges (3).
Actualmente los casos descritos en la literatura con este síndrome son escasos y más aún en los que reciben anestesia, por lo que no hay consenso en el manejo anestésico de dichos pacientes.
Se cuenta con la descripción de un caso del Síndrome de Susac con hipertensión intracraneal (HIC) grave manejado bajo anestesia general total intravenosa con propofol, fentanilo y rocuronio con adecuado control de la presión intracraneal y sin complicaciones, pero ninguno bajo anestesia regional.
Se sabe que la vaina del nervio óptico es una extensión de la duramadre y que el espacio subaracnoideo se continua con el espacio alrededor del nervio óptico (NO); así los cambios en la dimensión del NO son una manifestación temprana de los cambios en la presión intracraneal (PIC) (5) teniendo una correlación proporcional con presiones dentrode13–30mmHgdePIC,siendo5mmdeDVNO equivalente a 20 mm Hg. En nuestro caso se corroboro la HIC ligeramente por arriba de 20 mm Hg por lo que se clasifico como HIC leve (20–30 mm Hg) y ante rechazo de
la paciente a la anestesia general se procede al abordaje peridural tomando precaución ante los aumentos transitorio de la PI secundario a la administración de los bolos anestésicos mediante el monitoreo ultrasonográfico de la vaina del nervio óptico.
Si bien la anestesia neuroaxial esta descrita, como contraindicación relativa ante hipertensión intracraneal por el riesgo de descompresión abrupta de la cavidad craneal y herniación secundario a punción accidental de la duramadre; también se ha documentado que la anestesia epidural aumenta levemente la presión intracraneal (PIC) con cada bolo de anestésico local, dicho incremento se ha calculado a partir de 0.3 mL/kg el cual se disipa de 5–10 minuto tras su distribución en espacio peridural.
En cada bolo administrado se monitorizo la PIC por ultrasonido (USG) del nervio óptico de manera bilateral, no se observaron grandes alteraciones del DVNO, ni aumento la intensidad de la cefalea y no se presentaron síntomas agregados ni eventualidades.
Conclusión:
El presente artículo pretende mostrar una alternativa para el manejo anestésico de síndrome de Susac.
Es crucial conocer y comprender el curso y evolución de esta patología, así como los efectos de la técnica anestésica sobre estos pacientes.
En nuestro caso se evitaron los cambios hemodinámicos significativos y se manejó el dolor postoperatorio con bloqueo del canal de los abductores, evitándose la exposición a gases halogenados con efectos negativos para la PIC
Se considera que la elección del tipo de anestesia en estos pacientes debe estar basado en el grado de hipertensión intracraneal, el tipo de cirugía a realizar y el tiempo quirúrgico estimado.
Bibliografía
1. Saux AL, Niango G, Charif M, Morales RJ, Mura F, Bonafé A, Mourand I. Susac’s syndrome, a rare, potentially se- vere or lethal neurological disease. Journal of the Neu- rological Sciences 2010; 297(1-2): 71-73. DOI 10.1016/j. jns.2010.07.020
2. Dawe JA, Green AL. Headache in Susac’s syndrome. Cur- rent Pain and Headache Reports, 2021;25(4): DOI 10.1007/ s11916-021-00939-2
3. Marrodán M, Fiol M, Correale J. Susac Syndrome: Chal- lenges in the diagnosis and treatment. Brain 2021; 145(3): 858-871. DOI 10.1093/brain/awab476.
4. Greco A, De Virgilio A, Gallo A, Fusconi M, Turchetta R,
5. Pereira S, Vieira B, Maio T, Moreira J, Sampaio F. Susac’s Syndrome: An updated review. Neuro-Ophthalmology 2020;44(6): 355-360. DOI: 10.1080/01658107.2020.17480 62
6. Khandelwal A, Prasad C, Sokhal N, Chaturvedi A. Anesthe- tic management of a patient with SUSac syndrome: a rare neurological disorder. Saudi Journal of Anaesthesia 2020; 14(4): 551. DOI: 10.4103/sja.SJA_66_20
7. Heldt T, Zoerle T, Teichmann D, Stocchetti N. Intracranial pressure and intracranial elastance monitoring in neur- ocritical care. Annual Review of Biomedical Engineer- ing 2019; 21(1): 523-549. DOI: 10.1146/annurev-bio- eng-060418-052257
8. Ávila REI, De Guevara VLCL. De Jesús Montelongo F, Pérez, M. MR, Domínguez AC, Suárez AS. Medición del diámet- ro de la vaina del nervio óptico por ultrasonografía versus tomografía simple de cráneo en pacientes con trauma cra- neoencefálico. Medicina crítica 2020; 34(4): 221-230. DOI: 10.35366/95877
9. Guerci P, Vial F, Mcnelis U, Losser MR, Raft J, Klein O, Iohom G, Audibert G, Bouaziz H. Neuraxial anesthesia in patients with intracranial hypertension or cerebrospinal fluid shun- ting systems: what should the anesthetist know?. Miner- va anestesiologica 2014; 80(9): 1030–1045. Recuperado: https://acortar.link/l7Gkpc
10. ParkJ,HongJ,KimJ,YiS.TheEffectofDifferentPostureon Normal Saline Injection in Optic Nerve Sheath Diameter in Thoracic Epidural Anesthesia. Pain physician 2020; 23(6): 573–579. Recuperado: https://acortar.link/samGEK
Síndrome de Jacobsen Reporte de Caso: Descifrando la Incógnita en el Manejo Anestésico
Jacobsen Syndrome Case Report: Decoding the Unknown in Anesthetic Management
Anestesia en México 2024;36(2):
Fecha de recepción febrero 2024, fecha de revisión abril 2024, fecha de publicación mayo 2024
nancy.loredo.garcia@hotmail.com
Resumen.
El síndrome de Jacobsen (SJ) es causado por deleción parcial del brazo largo del cromosoma 11 (1). Los fenotipos de presentación tienen un amplio espectro de gravedad (1,2). Presentan alteraciones craneofaciales, malformaciones cardíacas, disfunción plaquetaria (3,4,5). Debido a las características de la patología y aunado a los pocos casos reportados resulta una incógnita el manejo anestésico estándar.
Reporte de caso: Masculino de 13 días de vida, 40 semanas de edad gestacional corregidas, 3870 gramos, 48 cm, diagnóstico de trisomía parcial 11q, malrotación intestinal, criptorquidia bilateral, vía aérea difícil (VAD) predicha. Programado para cirugía de laparotomía exploradora, procedimiento de Ladd y adherensiolisis bajo anestesia general balanceada. El manejo se debe centrar en la valoración y planeación anestésica, con particular atención al manejo de vía aérea (VA), mantenimiento de estado hemodinámico, anticipación y control de sangrado.
Abstract
Introduction: Jacobsen syndrome is caused by partial deletion of the long arm of chromosome 11 [1]. Phenotypes have a wide spectrum of severity (1,2). They present craniofacial alterations, cardiac malformations, platelet dysfunction (3,4,5). Due to the characteristics of the pathology and the few reported cases, a standard anesthetic management is unknown.
Case report:13 days old male, corrected gestational age of 40 weeks, weight 3870g, height 48cm and diagnosis of partial trisomy 11q, intestinal malrotation, bilateral cryptorchidism; scheduled for exploratory laparotomy, Ladd’s procedure and adherensiolysis.under balanced general anesthesia.
Conclusion: The management should focus on anesthetic assessment and planning, with particular attention
to airway management, hemodynamic status and anticipation to bleeding.
Keywords: Jacobsen syndrome, 11q deletion syndrome, coagulopathy
Introducción
El SJ es causado por la deleción parcial del brazo largo del cromosoma 11, suele ser una alteración de novo (85 %) (1). Incidencia de 1/100 000 aproximadamente, relación mujer/hombre de 2:1 (1). Aproximadamente 300 casos clínicos de SJ han sido reportados en la literatura (1,2). Los fenotipos de presentación tienen un amplio espectro de gravedad, las deleciones más grandes suelen mostrar manifestaciones clínicas más graves (1). Presentan alteraciones craneofaciales, malformaciones cardíacas, disfunción plaquetaria entre otras afecciones (3,4,5).
Caso Clínico
Paciente masculino de 13 días de vida, 40 semanas de edad gestacional corregidas, peso 3870 gramos, talla 48 centímetros, diagnóstico de trisomía parcial 11q, malrotación intestinal, criptorquidia bilateral, vía aérea difícil predicha, presentado para laparotomía exploradora. Exploración física; paciente reactivo a estímulos, tono muscular disminuido, dolicocefalia, parpados edematizados, puente nasal deprimido y ancho, filtrum largo, labios delgados, boca en forma de V invertida, retrognatia, pabellones auriculares de implantación baja con rotación posterior, sobre plegamiento de hélix, lóbulo evertido, cuello corto con piel redundante en nuca (Figura 1), pectus excavatum, teletelia, pezones hipoplásicos, sin soplos cardiacos, abdomen depresible, micropene, miembros íntegros simétricos, dedos cónicos, braquidactilia, pliegues aberrantes, piel redundante en miembros inferiores, halluces anchos e hipoplasia ungueal de ortejos, hipermovilidad articular, llenado capilar dos segundos. Paciente con uso de CPAP, presión inspiratoria 5 cm H2O, fracción inspirada de oxígeno (FiO2) 28 %, sonda orogástrica con gasto biliar, catéter venoso yugular derecho.
Valoraciones preoperatorias
Valoración genética: trisomía parcial 11q, monosomía parcial 15p, cariotipo 46.XY.der(15)t(11:15)(q12:p11). Cardiología pediátrica: sin repercusión hemodinámica. Endocrinología pediátrica: tamizaje sospechoso para deficiencia de glucosa-6-fosfato-
deshidrogenasa y riesgo de hipopituitarismo.
Estudios de gabinete: Ultrasonido transfontanelar: agenesia del cuerpo calloso. Ultrasonido abdominal y pélvico: hipoplasia testicular bilateral e hidrocele. Ecocardiograma transtorácico: arco aórtico izquierdo con origen común del tronco braquiocefálico, carótida común izquierda, dilatación de la aorta ascendente 11 mm. Estudios de laboratorio
Urea 36 mg/dL, BUN 16.8 mg/dL, creatinina 1 mg/dL, Hemoglobina 15.8 g/dL, hematocrito 45.3 %, plaquetas 257 mil/mm3 (previas de 170 mil/mm3), TP 11.8 segundos, INR 1.03, TTP 23.7 seg, fibrinógeno 374 mg/dL, glucosa-6- fosfato-deshidrogenasa 2.3U/g Hb.
Manejo anestésico
Anestesia general balanceada. Se realizó monitorización básica, Tensión arterial 74/43(55) mm Hg, Frecuencia cardiaca 156 lpm, frecuencia respiratoria 48 rpm, temperatura 36.8°C, Saturación de oxígeno (SpO2) 93 %. Se realizó alineación de ejes oral, faríngeo y laríngeo (Figura 2), se pre oxigena con máscara facial FiO2 90 % 3L/ min, inducción anestésica: Fentanilo 15 μg, sevoflurano 2 %, obteniendo Ramsay 6, apoyo con ventilación presión positiva menos de 10 cmH2O, observando adecuada ventilación, rocuronio 400 μg, videolaringoscopía con equipo OnFocus hoja miller uno. Observando abundantes secreciones hialinas con trazos hemáticos, se aspiran visualizando POGO 100 % se introduce tubo endotraqueal 3.5 sin globo. Ventilación con modo presión control, mandatoria continua, esquema de control fijo, presión inspiratoria 12-16 cmH2O para un volumen tidal de 6 mL/ kg, frecuencia respiratoria 45-55 rpm, EtCO2 32-35 mm Hg, FiO2 35-45 %, relación I:E 1:2, PEEP 5 cm H2O. Mantenimiento anestésico: fentanilo 0.039-0.056 μg/ kg/min, dosis total 36.4 μg, gluconato de calcio 30 mg/ kg/h, Sevofluorano 0.5-0.7 CAM, se mantienen líquidos calculados al 50 %. Adyuvante: Paracetamol 58 mg iv. Transanestésico sin eventualidades, hemodinámicamente estable. Balance Hídrico: Ingresos 82.2 mL, Egresos 97.43 mL, sangrado 5 mL, balance -15.23 mL
Anestesia sin eventualidades, se deja a paciente orointubado por petición de cirugía. TA 93/59 mm Hg, FC 160 LPM, FR 55 rpm, SpO2 97 %. Duración de anestesia una hora 55 minutos, duración de cirugía una 20 minuto.
Cirugía realizada: procedimiento de Ladd y adherensiolisis.
Discusión
Se han reportado menos de 10 casos de trisomía parcial 11q pura. En este caso aun con la monosomía parcial 15, corresponde a fenotipo de trisomía 11q pura a pesar de no ser causada por duplicación 11q.
Los pacientes con SJ nacen a término en más del 60 % de los casos, pretérmino 30 % y postérmino en menos de 10 % de los casos [1]. El peso al nacer es normal en 60 % de los bebés, debajo del percentil 10 en 37 %, solo el 3 % de los niños tienen un peso al nacer por arriba del percentil 90 (1). Las características clínicas más comunes incluyen: retraso del crecimiento físico prenatal y posnatal, retraso psicomotor, dismorfismo facial, macrocráneo, frente amplia y prominente, asimetría facial, trigonocefalia, hipertelorismo ocular, fisuras palpebrales inclinadas hacia abajo, estrabismo, ptosis palpebral, cejas escasas, pliegues epicánticos, puente nasal ancho, plano o prominente, nariz corta, narinas antevertidas, orejas pequeñas de inserción baja malformadas y con rotación posterior, lóbulo hipoplásico, filtrum largo y plano, boca en forma de “v”, labio superior delgado, retrognatia, cuello corto [1,3]. Las manos muestran sindactilia, regiones hipotenares hipoplásicas, pliegues palmares anormales, regiones tenares hipoplásicas. Los pies son rechonchos y planos, con el primer ortejo grande y largo, clinodactilia, braquidactilia, sindactilia del segundo y tercer dedo de los pies, dedos de los pies apretados.
56 % de los casos tiene malformaciones cardiacas, 2/3 son comunicaciones interventriculares o malformaciones obstructivas del corazón izquierdo: anomalías de las válvulas aórtica o mitral, coartación de la aorta, complejo de Shone o síndrome del corazón izquierdo hipoplásico [1]. Hasta en el 95 % de los niños fallecidos se reportó alguna malformación cardiaca [1].
Las malformaciones del tracto gastrointestinal ocurren en el 18 % de los casos, incluyendo estenosis pilórica, anomalías anales (atresia o estenosis, o ano anteriorizado), con menos frecuencia atresia duodenal, páncreas anular o malrotación intestinal (1,6).
En 5 % de los pacientes se encontró algún tipo de anomalía estructural cerebral: ventrículos agrandados con o sin espina bífida, atrofia cerebral, agenesia del cuerpo calloso, paquigiria (1).
En el 13 % se reportan malformaciones del sistema urinario: displasia renal unilateral, uréteres dobles, hidronefrosis, riñones multiquísticos. La criptorquidia se observa en el 36-60 % de los varones en informes publicados. Las hernias inguinales se observan en el 15 % de los niños.
En el 14 % presenta alguna anomalía esquelética, como espina bífida oculta, anomalías del cuerpo vertebral, anomalías torácicas, número anormal de costillas, micromelia, hexadactilia. Se observan anomalías ortopédicas en el 19 % de los niños, como dislocación de la cadera, escoliosis, pie plano o pie zambo. También pueden presentarse problemas auditivos, inmunológicos y hormonales [1].
La mayoría nacen con trombocitopenia o pancitopenia, se ha sugerido que la anormalidad plaquetaria en el SJ y el síndrome de Paris-Trousseau son la misma condición; afectando hasta el 95 % de los casos, presentando trombocitopenia neonatal que puede resolverse con el tiempo, pero las anomalías plaquetarias funcionales suelen persistir resultando en hemorragia [1,4]. En el frotis de sangre periférica se observa a menudo plaquetas grandes punteadas (4). Aunado a esto los pacientes pueden tener estudios de coagulación normales, pero tiempos de sangrado prolongados (4).
Debido a las patologías presentes en la mayoría de los niños con JS, tienen hospitalizaciones prolongadas, particularmente en el periodo neonatal asociados a dificultad de alimentación, problemas cardíacos y/o problemas de sangrado (1). Alrededor del 20 % mueren durante los dos primeros años de vida, asociado a complicaciones cardiacas y a hemorragias. La esperanza de vida en pacientes más allá de la infancia es desconocida (1,4).
Manejo anestésico
Tomando en cuenta las características de la patología, el manejo en estos pacientes se debe centrar en la valoración y planeación anestésica, con particular atención en el manejo de vía aérea, mantenimiento del estado hemodinámico, anticipación y control de sangrado.
La valoración preanestésica debe contar con:
• Valoración cardiológica; ecocardiograma.
• Valoración neurológica; estudios de imágenes cerebrales.
• Ultrasonido abdominal.
• Biometría hemática, estudios de función plaquetaria, tiempo de sangrado.
• Disponibilidad en banco de sangre; plaquetas profilácticas o sangre completa pueden ser necesarias antes, durante o después de la cirugía (1).
• Planificación del abordaje de vía aérea; ventilación e intubación pueden ser difíciles.
Aunque en uno de los casos reportados por Easley et, al (4) se observó cormack II posterior a presión cricoidea, la mayoría de las laringoscopias directas reportadas observan
Las anormalidades plaquetarias y los problemas de coagulación resultantes requieren una valoración minuciosa antes del procedimiento debido a que la literatura ha mencionado el riesgo de presentar sangrado importante [7], desarrollo de hemorragias cerebrales [8] y hematomas en pacientes con SJ, como fue reportado en el caso de Takeda et. al (5), durante el postoperatorio, sin embargo, no hay suficientes reportes previos sobre el manejo intraoperatorio de estos pacientes.
Resulta de vital importancia contar con disponibilidad de plaquetas durante el procedimiento, así también se ha sugerido el uso de intervenciones para mejora de la función plaquetaria como sería el caso de desmopresina, sin embargo, hasta el momento no hay evidencia del beneficio de su uso en este síndrome (4).
Resultaría útil el uso de tromboelastografía para guiar
la decisión de transfusión y/o uso de antifibrinolíticos
[4,5], el recuento plaquetario y la función plaquetaria 5. requieren monitoreo continuo y cuidadoso durante
la anestesia, sin embargo, el efecto de la disfunción plaquetaria en el síndrome de Jacobsen sobre el resultado
del tromboelastograma requiere mayores estudios.
En tromboelastogramas transoperatorios de los pocos reportes de casos de estos pacientes, principalmente en cirugías cardiacas como en el caso de Takeda et. al (5),
se observan valores plaquetarios normales y tiempos de sangrado prolongados, sugieren que presentan deficiencia
de factores de coagulación y función plaquetaria anormal
[5].
Las recomendaciones de hematología de los reportes de casos previos consisten en la transfusión de concentrados plaquetarios de manera temprana ante la evidencia de sangrado, como lo reporta en el caso de Easley B. et. al y
Goeller JK et. al. (2,4).
Conclusión:
Debido a las alteraciones presentes en el síndrome de Jacobsen es necesario prever la posibilidad de complicaciones en el perioperatorio, las principalmente esperadas son las relacionadas al manejo de la VA debido a la VAD predicha y a las relacionadas al sangrado debido a las alteraciones en la disfunción plaquetaria y en factores de coagulación que pudieran estar presentes. Es imperativo realizar una valoración multidisciplinaria preoperatoria para contar con la información necesaria para planificar el camino a seguir y prever en caso de presentar las complicaciones comentadas. Se requiere mayor estudio para valorar la seguridad del bloqueo neuroaxial y/o regional.
Referencias:
1. Mattina T, Perrotta CS, Grossfeld P. Jacobsen syndrome. Or- phanet J Rare Dis. 2009:4-9. doi: 10.1186/1750-1172-4-9. PMID: 19267933; PMCID: PMC2670819.
2. Goeller JK, Veneziano G, Tobias JD. Perioperative mana- gement of a patient with Jacobsen syndrome. Pediatric Anesth and Crit Care J. 2015;3(1):26-31. doi:10.14587/pac- cj.2015.5
3. Bissonnette B, Luginbuehl I, Engelhardt T. Jacobsen syndro- me In: Syndromes: Rapid Recognition and Perioperative Im- plications, 2e. McGraw Hill, 2019. https://accessanesthe- siology.mhmedical.com/content.aspx?bookid=2674&sec- tionid=220533806
4. Easley B, Sanders D, Mcelrath-Schwartz J, Martin J, Red- mond M. Anesthetic implications of Jacobsen syndrome.
5.Takeda C, Hirotsu A, Yasuhara G, Mizuno A, Tatsumi K, Kawamoto S. Utility of thromboelastogram in cardiac sur- gery in Jacobsen syndrome associated with platelet dys- function: a case report. JA Clin Re. 2022;8(67):1-5. doi: 10.1186/s40981-022-00557-w. PMID: 35989376; PMCID: PMC9393117
6. Fernández-González N. Prieto Espuñes S. Ibáñez Fernández, A. Fernández Colomer, B. López Sastre, J. Fernández Toral, J. Deleción terminal del 11q (síndrome de Jacobsen) asocia- da a atresia duodenal con páncreas anular. An Esp Pediatr 2002;57(3):249-52. DOI: 10.1016/S1695-4033(02)77913-7
7. Ichimiya Y, Wada Y, Kunishima S, Tsukamoto K, Kosaki R, Sago H, Ishiguro A, Ito Y. 11q23 deletion syndrome (Jacob- sen syndrome) with severe bleeding: a case report. J Med Case Rep. 2018;12(1):3 doi: 10.1186/s13256-017-1535-5. PMID: 29307309; PMCID: PMC5757304.
8. Grossfeld P. Brain hemorrhages in Jacobsen syndrome: A retrospective review of six cases and clinical recommenda- tions. Am J Med Genet A. 2017 Mar;173(3):667-670 doi: 10.1002/ajmg.a.38032. PMID: 28211970.
Fístula Cutánea de LCR Secundario a Catéter Epidural en Paciente Pediátrico: Reporte de Caso
Cutaneous CSF Fistula Secondary to Epidural Catheter in Pediatric Patient: Case Report
Anestesia en México 2024;36(2):
Fecha de recepción noviembre 2024, fecha re revisión febrero 2024, fecha de publicación mayo 2024.
mariadejesuscc95@gmail.com
Resumen.
La fístula cutánea de líquido cefalorraquídeo (FLCR) es una salida anormal de LCR secundario a una ruptura de la duramadre y la aracnoides, sus causas son traumáticas, por procedimientos quirúrgicos o diagnósticos. La FLCR es una complicación rara y grave de la anestesia epidural. Paciente pediátrico de ocho años, con una FLCR secundaria a la punción inadvertida de duramadre, durante un procedimiento de anestesia neuroaxial a nivel lumbar. Después de retirar el catéter epidural, la madre informa de la salida de líquido claro en la región lumbar. Se confirma la FLCR. Inicia tratamiento con esteroide y diurético, logrando una disminución progresiva de la fuga de LCR a las 72 horas. Sin síntomas de cefalea postpunción se da seguimiento hasta la completa cicatrización del sitio de punción. La FLCR es una complicación rara en niños, y su manejo conservador puede ser efectivo, destacando
Palabras clave: catéter epidural, punción inadvertida de duramadre, fístula cutánea de LCR.
Abstract
Cutaneous cerebrospinal fluid fistula (CSF) is an abnormal outflow of CSF secondary to a rupture of the dura mater and the arachnoid, its causes are traumatic, surgical or diagnostic procedures. FLCR is a rare and serious complication of epidural anesthesia. Eight-year-old pediatric patient with FLCR secondary to inadvertent puncture of the dura mater during a neuraxial anesthesia procedure at the lumbar level. After removing the epidural catheter, the mother reports clear fluid leaking into the lumbar region. The FLCR is confirmed. She began treatment with a steroid and diuretic, achieving
a progressive decrease in CSF leak after 72 hours. Without symptoms of post-puncture headache, follow- up is carried out until the puncture site is completely healed. FLCR is a rare complication in children, and its conservative management can be effective, highlighting the importance of early diagnosis and an individualized therapeutic approach.
Keywords: epidural catheter, inadvertent dura mater puncture, anesthetic complications, CSF cutaneous fistula.
Introducción
La FLCR se define como la salida anormal de líquido desde el cráneo al exterior (1). Es una complicación rara pero potencialmente grave de la analgesia epidural (2); de lo cual existe poca bibliografía en la que se describa este suceso en procedimientos anestésicos. Describiéndose en reportes de caso, como una complicación rara y excepcional de la cual no existe un consenso o manejo sobre su abordaje clínico (3). Esto en caso de la anestesia obstétrica (4,5). En pacientes pediátricos existen escasa evidencia reportada. (6). Las complicaciones más raras mencionadas y de las cuales se tiene también reporte de caso van desde la sección de catéter epidural, creación de nudo verdadero o incluso migración de este (7–9).
Presentación del caso clínico
Paciente masculino de 8 años, programado de urgencia para laparotomía exploradora (LAPE) por probable perforación intestinal. Antecedente de múltiples anestesias neuroaxiales y generales por LAPE secundario a herida por arma de fuego sin complicaciones, resto negado. Exploración física peso: 43 kg, talla 142 cm, signos vitales en parámetros de normalidad. Cráneo normocefalo, campos pulmonares bien ventilados, abdomen con presencia de heridas quirúrgicas bien afrontadas presencia de bolsa recolectora en ostomía, globoso con datos de irritación peritoneal. Extremidades integras. Exámenes de laboratorio anemia grado uno de la OMS, resto en parámetros de normalidad, para el manejo anestésico se optó por anestesia mixta: Anestesia general (AG) más anestesia neuroaxial bloqueo subaracnoideo (BSA) más catéter epidural, previo consentimiento de familiar; Monitoreo no invasivo. Manejo anestésico anestesia general (AG): midazolam 3 mg, fentanilo 200 μg, propofol 150 mg, laringoscopia directa hoja Mac tres, Comarck Lehane I, intubación sin complicaciones. Ventilación mecánica
Figura 1: Orificio de punción con gota de líquido.
El paciente se mantuvo asintomático con EVA de 0 a dos de diez, tolera vía oral. Se inicia tratamiento con esteroide (dexametasona 0.15 mg/kg/día) y diurético de asa (furosemida 10 mg i.v, cada 12 horas) reposo absoluto y posición prona. Se realiza vigilancia de los mililitros de LCR que fugan por la fistula cutánea cada 24 horas (siendo 4 mL en 24 horas al inicio) remitiendo a las 72 horas de tratamiento ya sin salida de LCR por el orificio de punción, se inicia deambulación de paciente sin presentar ningún síntoma de cefalea postpunción, ni salida de líquido, se da seguimiento hasta alta sin eventualidades.
Discusión
La FLCR es una complicación rara, tanto en adultos como en niños, de la cual falta información y más relacionado con los procedimientos anestésicos, ya que su etiología no es clara. Puede tener muchas complicaciones, al no ser reconocida o tratada (en caso de no ser correctamente manejada presenta alto riesgo de meningitis). Cuando se observa drenaje de líquido a través del catéter epidural, o sitio de inserción de este, el primer paso debe ser hacer un diagnóstico diferencial entre LCR, y líquido intersticial
(10). El diagnóstico puede ser más desafiante en niños que aún no hablan, en quienes podemos encontrar síntomas inespecíficos como irritabilidad, somnolencia o puede haber rechazo de la alimentación. No existe un enfoque terapéutico estandarizado, para FLCR y los tratamientos seleccionados varían. Inicialmente, el tratamiento es conservador: reposo en cama (que reduce la pérdida de LCR e hipotensión intracraneal), líquidos, analgesia y profilaxis antibiótica. Cuando estas medidas no son suficientes y la fuga de líquido persiste, se utilizan otras opciones, como la sutura cutánea en el sitio epidural o parche sanguíneo (10).
En este caso, el paciente nunca presentó síntomas de cefalea postpunción y respondió adecuadamente a tratamiento conservador, sin ser necesario la realización de otras estrategias, ya que fue disminuyendo progresivamente la fuga de LCR hasta remitirse.
Conclusión
El desarrollo de una FLCR es raro, particularmente en niños. Un alto índice de sospecha y una pronta gestión, son esenciales para su reconocimiento y tratamiento para evitar cualquier otra complicación agregada. Es importante considerar, que la clínica y signos en pacientes pediátricos, pueden ser menos específicos que en adultos. El parche sanguíneo epidural es una opción de tratamiento, si el manejo conservador no es satisfactorio, sin embargo, faltan recomendaciones para su manejo.
Referencias.
1. Martínez-Ruiz-Coello M del M, Bosco-Morales G, Gar- cía-Chillerón R, Miranda-Sánchez E, Apezteguia JC, Pla- za-Mayor G. Fístula de líquido cefalorraquídeo traumática tras realización de test PCR mediante hisopo nasal para la detección de COVID-19. Descripción de un caso. Revista ORL. 2022; 4;13(1):e27908.
2. Lenart MJ, Carness JM. Cerebrospinal Fluid-Cutaneous Fis- tula After Continuous Spinal Catheter in an Obstetric Pa- tient. A A Case Rep. 2016;7(5):103–107.
3. Marinho R, Sousa M, Machado F, Fonseca S, Guedes L. Cerebrospinal fluid cutaneous fistula after neuraxial anes- thesia: an effective treatment approach. Scand J Pain. 2018;25;18(4):739–741.
4. Gordon C, Fry C, Salman M, Desai N. Meningitis following cerebrospinal fluid-cutaneous fistula secondary to combi- ned spinal-epidural anaesthesia for elective caesarean deli- very. Int J Obstet Anesth. 2022;49:103241.
6. González Arellano A, Ibacache M, De la Fuente R, Rolle A, Vega E. Eficacia analgésica y complicaciones a corto plazo de catéteres peridurales lumbares y torácicos en pacientes pediátricos: una evaluación retrospectiva. ARS med (San- tiago, En línea) [Internet]. 2018 Nov 22 [cited 2023 Dec 9];43(3):33–41. Available from:
7. https://arsmedica.cl/index.php/MED/article/ view/1518/1348.
8. Santiago AgustinP de PMDL. Catéter epidural seccionado: reporte de un caso y revisión de literatura. Revista Médica del Uruguay. 2022; 6;38(2).
9. Garabito-López JA. Nudo verdadero en catéter peri- dural. Reporte de un caso. Rev mex anestesiol [Inter- net]. 2019 [cited 2023;(9);68–71. Available from: http:// www.scielo.org.mx/scielo.php?script=sci_arttext&pi- d=S0484-79032019000100068
10. Ida M, Sumida M, Kawaguchi M. Intraoperative subarach- noid migration of the epidural catheter used for continuous infusion leading to delayed detection. J Clin Anesth. 2019; 55:115.
11. Franklin AD, Hays SR. Successful management of a thora- cic cerebrospinal fluid cutaneous fistula in a two year old child using a thoracic epidural blood patch. J Clin Anesth. 2013;25(4):331–334.
Gastrosquisis: Manejo que Todo Anestesiólogo Debe Conocer
Gastroschisis: Management that Every Anesthesiologist Should Know
Anestesia en México 2024;36(2):
Fecha de recepción enero 2024, fecha de revisión abril 2024, fecha de publicación mayo 2024.
nancy.loredo.garcia@hotmail.com
Resumen.
La gastrosquisis es un defecto paraumbilical de la pared abdominal, por el que protruyen vísceras de forma parcial y/o total, involucra generalmente al intestino, la protrusión de otros órganos es menos común. Al no tener recubrimiento membranoso los órganos están directamente expuestos (1,2). Tiene una incidencia de uno de 4000 nacidos vivos. Aunque la etiología es desconocida, la teoría más aceptada es la de lesión vascular de la arteria onfalomesentérica (3). Es una urgencia neonatal que requiere de manejo inmediato, presentándose en cualquier lugar y nivel hospitalario, por lo cual es necesario que todo anestesiólogo este familiarizado con el manejo de estos pacientes y conocer los puntos principales a tratar con el objetivo de disminuir complicaciones y por lo tanto mortalidad (1). Reporte de caso: Se presenta el manejo anestésico de un paciente femenino, dos días de vida, con diagnóstico de gastrosquisis que involucra hígado, bazo, estómago, intestino y colon para colocación de bolsa de silo.
Palabras clave: gastrosquisis, neonato, presión intraabdominal, presión plateau
Abstract
Introduction: Gastroschisis is a paraumbilical defect of the abdominal wall, through which viscera protrude partially and/or completely, it generally involves the intestine, the protrusion of other organs is less common, as they do not have a membranous covering the organs are directly exposed (1,2). It has an incidence of uno in 4000 live births. Although the etiology is unknown, the most accepted theory is that of vascular injury to the omphalomesenteric artery (3). It is a neonatal emergency that requires immediate management, occurring in any place and hospital level, which is why it is necessary that every anesthesiologist is familiar with the management of these patients and knows the main points to be treated with the aim of reducing complications and therefore so much mortality (1). Case report: The anesthetic management of a female patient, dos days old, with a diagnosis of gastroschisis involving the liver, spleen, stomach, intestine and colon for placement of a silo bag is presented.
Keywords: gastroschisis, neonate, intra-abdominal pressure, plateau pressure.
Introducción
La gastrosquisis (GQ) es un defecto de la formación y desarrollo de la pared abdominal durante la embriogénesis, usualmente paraumbilical derecho (4), por el que protruyen vísceras de forma parcial y/o total, involucra generalmente al intestino, la protrusión de otros órganos es menos común, los órganos herniados al no tener recubrimiento membranoso están directamente expuestos al líquido amniótico, por lo que presentan una exfoliación inflamatoria y engrosamiento de la pared generando una capa de fibrina (1,2). Esta patología se categoriza en simple o compleja dependiendo de la ausencia o presencia de: atresia intestinal, estenosis, perforación o necrosis intestinal, malrotación o vólvulo, asociados hasta en un 25 % (4). Se asocia con mucha menos frecuencia a otras anomalías, pero hasta en el 5-15 % pueden presentar malformaciones extra intestinales asociadas (2). Tiene una incidencia de uno de 4000 nacidos vivos (3), con una relación hombre: mujer de 3:2 (1), mortalidad es menor o igual a 5 % (2,3). Aunque la etiología es desconocida, la teoría más aceptada es la de lesión vascular de la arteria onfalomesentérica (3,5,6).
Es considerada una urgencia neonatal, si bien el manejo de manera ideal debe darlo un equipo con experiencia en este tipo de pacientes, es importante resaltar que se requiere manejo inmediato en las primeras horas de vida debido a que los pacientes con gastrosquisis son extremadamente susceptibles a la perdida de líquidos y calor asociado a la exposición de vísceras (1), el manejo pronto ayuda a disminuir complicaciones como isquemia, compromiso circulatorio, infecciones [4] por lo tanto también ayuda a disminuir la mortalidad, por lo que es importante que todos los anestesiólogos estén familiarizados con los puntos principales del manejo y cuidado en estos pacientes (1).
Caso clínico
Femenino de dos días de vida referida de su hospital de nacimiento con diagnóstico de gastrosquisis que involucra hígado, bazo, estómago, intestino y colon (Imagen I) para colocación de bolsa de silo (Imagen II). Producto de gesta 1, 35 SDG por Capurro. A la exploración física la paciente tiene peso de 1790 gramos, se encuentra con puntas nasales a 3 litros/minuto, saturando 93 %, sin uso de vasopresores, con soluciones calculadas por catéter PICC en miembro superior derecho, sonda orogástrica a derivación y sonda urinaria. Laboratorios: hiponatremia leve, acidosis respiratoria compensada (Tabla I), resto sin relevancia. Previo a pasar a quirófano presenta deterioro respiratorio desaturando hasta 60 % en área de
Imagen I: gastrosquisis que involucra hígado, bazo, estómago, intestino y colon.
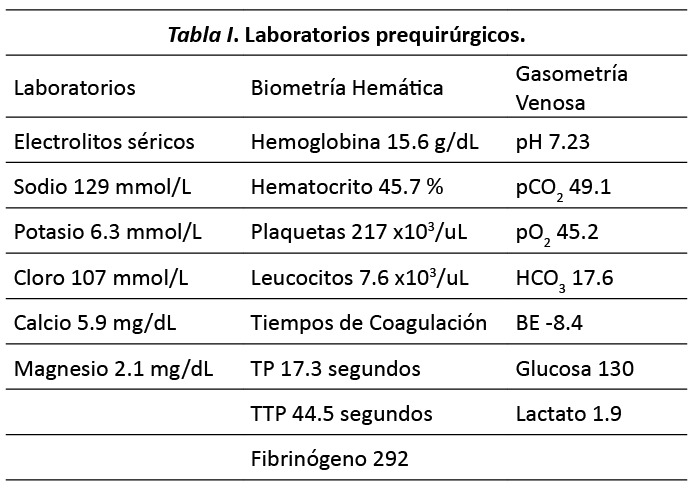
Manejo Anestésico
En área de cuidados intensivos neonatales se encuentra con los siguientes signos vitales: tensión arterial 80/37 mm Hg, frecuencia cardiaca 164 lpm, frecuencia respiratoria
80 %, se realiza inducción con fentanilo dos microgramos/kilogramo intravenoso (iv), midazolam 100 microgramos/kilogramo (iv), con el objetivo de mantener ventilación espontánea y evitar así la depresión y deterioro respiratorio, presentando saturación en 77 % por lo que se decide realizar asistencia ventilatoria con equipo bolsa mascarilla con presiones menores de 10 cmH2O mejorando la saturación a 91%, se realiza videolaringoscopía con equipo CMAC hoja miller 0, observando Cormack-Lehane IIB, glotis edematizada, se coloca tubo 3.0 sin globo, se fija a ocho centímetros, se traslada a quirófano, a su llegada a quirófano se realiza monitorización no invasiva, temperatura inicial 33°C, se conecta a circuito anestésico, se toma vía periférica número 26 en miembro torácico izquierdo, glucemia capilar inicial 110 miligramos/decilitro. Para el mantenimiento se usa sevofluorano CAM 0.3-0.4, perfusiones: Gluconato de calcio 30 miligramos/kilogramo/hora, fentanilo 0.013 microgramos/kilogramo/minuto, dosis total 1.9 microgramos, cisatracurio 200 microgramos (iv). Ventilación mecánica: se realiza medición de presión plateau basal de 12 cm H20 en ventilación con modalidad controlada por volumen, posteriormente se cambia a controlada por presión, configuración de ventilador presión inspiratoria 9 cm H2O, manteniendo volumen tidal de 7-8 mL/kg, frecuencia respiratoria 33-35 rpm, I:E 1:1.5, presión espiratoria final positiva (PEEP) 4 cm H2O, ETCO2 18-20 mm Hg, presión pico 18 cm H20, FIO2 50 %. Bajo efectos de anestesia general se realiza bloqueo caudal dosis única con ropivacaína 0.2 %, volumen 1.25 mililitros/
kilogramo, 2.5 miligramos/kilogramo. Se mantienen líquidos de base con glucosa/kilo/minuto de 3.
Se mantiene hemodinámicamente estable en transanestésico sin requerimiento de vasopresores, con temperatura 33-34.5°C con uso de dos calentadores de aire, colchón térmico y soluciones calientes. Ventilatoriamente: Presión plateau basal 12 cm H2O, al introducir bazo a cavidad abdominal presenta elevación de presión pico a 35 cm H2O, se realiza medición de presión plateau obteniendo 29 cm H2O por lo cual se le comenta al equipo quirúrgico y se retira parcialmente el bazo midiendo 17 cm H2O en presión plateau, presión pico de 23 cm H2O, ETCO2 21 mm Hg.
Manejo de líquidos: Ingresos 35.8 mililitros (albúmina 5 % 30 mL, solución salina 0.9 % y soluciones calculadas). Egresos 41.8 mililitros, gasto urinario 1.1 mililitros/ kilogramo/hora, balance Hídrico -6 mililitros, Sangrado: 2 mililitros. Signos vitales finales: tensión arterial 78/47 mm Hg, frecuencia cardiaca 135 lpm, frecuencia respiratoria 34 rpm, saturación 97 %, temperatura 35°C, peso 1740 g, duración de cirugía 40 min, duración de anestesia una hora 30min. Se traslada orointubada a unidad de cuidados intensivos neonatales.
Discusión:
La valoración preanestésica en el paciente con GQ debe incluir valoración respiratoria minuciosa para detectar compromiso respiratorio, pulsioximetria, exploración física, radiografía de tórax para detectar áreas que sugieran aspiración o infección (4). Dentro de los estudios de laboratorio es de relevancia una biometría hemática completa, electrolitos séricos y gasometría arterial para valorar la adecuada resucitación hídrica y la ventilación, contar con biodisponibilidad sanguínea. Los pilares en el manejo inicial incluyen resucitación hídrica, cuidado de las vísceras herniadas, descompresión intestinal mediante sonda orogástrica y regulación de la temperatura.
Manejo hídrico
La pérdida de líquidos por evaporación favorece la hipovolemia, hipotermia, presencia de trastornos hidroelectrolíticos, estados de acidosis (llegando a provocar la apertura de los cortos circuitos y posible retorno de la circulación transicional a la fetal), el mal manejo hídrico además puede tener consecuencias desfavorables debido a la sobrecarga de fluidos (7).
El manejo implica mantener líquidos basales asociados a bolos de cristaloides o coloides (albúmina) 10-20 mililitros/ kilogramo, siempre determinados mediante valoración clínica hemodinámica, manteniendo gasto urinario de 1-2
mililitros/kilogramo/hora, monitorizando estrictamente la perdida sanguínea y realizando transfusión en caso necesario (1), manteniendo adecuado llenado capilar y estado acido base estable (7).
Regulación térmica
Todos los neonatos tienen riesgo de hipotermia como consecuencia de su gran relación entre la superficie y el peso corporal, la reducción de la grasa subcutánea y la escasa capacidad para temblar en respuesta al frío, la cual se exacerba debido a la exposición de las vísceras, por lo que el traslado del paciente debe realizarse en incubadora, manteniendo temperatura ambiental de 25-26°C, usando colchón térmico, humidificación, calentamiento de gases inhalados y líquidos intravenosos (1,4).
Manejo anestésico
Generalmente estos pacientes llegan con sonda orogástrica para descompresión intestinal, es importante realizar la aspiración de la misma, pues se consideran estómago lleno [1,4]. La técnica de intubación con técnica de secuencia rápida o secuencia rápida modificada son las más indicadas [4], en particular en este paciente se consideró el mantener la ventilación espontanea para evitar el mayor deterioro respiratorio al momento de la inducción, así también se asistió con ventilación manual con presiones bajas para optimizar la saturación del paciente. Es necesario contar con dos accesos venosos, preferente en extremidades superiores ya que la presión abdominal puede restringir el retorno venoso temporalmente después de la operación (4). El bloqueo caudal dosis única provee adecuada analgesia y mejora la relajación de la pared abdominal, lo cual es importante mantener y con mayor relación si el tamaño del defecto es grande (1,4), el bloqueo caudal está asociada con mínimas alteraciones cardiovasculares y respiratorias, ofreciendo estabilidad hemodinámica, reduce además la respuesta de estrés quirúrgico. (8), disminuyendo el requerimiento de opioide evitando la depresión respiratoria en pacientes quienes se planee extubación postoperatoria, lo que idealmente se debe realizar en forma temprana (7).
La anestesia caudal se contraindica en caso de sepsis neonatal instaurada o coagulopatía, situaciones frecuentemente asociadas a esta patología, donde la anestesia sería exclusivamente general [7].
Debido a las particularidades del corazón del neonato, su inmadurez hace al gasto cardíaco dependiente de frecuencia cardiaca y sin las suficientes reservas de calcio intracelular por
limitación de almacenamiento dentro del retículo
La reparación quirúrgica usualmente se realiza en las primeras horas del nacimiento (1), si la perfusión intestinal se ve comprometida se convierte en una emergencia. Las alternativas incluyen reducción y cierre primario o reducción gradual mediante bolsa de silo con cierre diferido (1,2).
La monitorización básica incluyendo temperatura continua, gasto urinario, control gasométrico, la colocación de línea con manómetro en vejiga (de elección (9) ) o estómago para monitorizar la presión intraabdominal si el cierre primario es contemplado era clásicamente usada, sin embargo no en todos los lugares se cuenta con estos medios, por lo que el monitoreo ventilatorio es esencial, principalmente la presión plateau que es de especial interés ya que representa la presión estática del retroceso elástico al final de la inspiración del sistema respiratorio total, aumenta mediante el desplazamiento hacia arriba del diafragma, como en el caso de una gran distensión abdominal, por lo que es una forma de medir de manera indirecta la presión intraabdominal [9], los parámetros ventilatorios establecidos son cruciales para la medición ya que volúmenes muy altos o muy bajos pueden dar una presión plateau alta o baja y malinterpretar la presión intraabdominal, la presión plateau de 10-12 cmH2O al inicio del cierre indicaría una configuración correcta sin compromiso respiratorio, indicando una presión intraabdominal de 0-2 cm H2O, en el estudio realizado por Banieghbal Et. al (9), para la medición de presión plateau, los parámetros ventilatorios se configuraron de la siguiente manera: recién nacidos menos de 2,5 kg: frecuencia respiratoria de 40/minuto; volumen respiratorio de 10 mL/kg; PEEP de cero; recién nacidos mayor de 2,5 kg: se utilizan los mismos ajustes que antes, pero volumen respiratorio fijado en 8 mL/ kg. Se observó que a medida que se reduce o cierra la pared abdominal la presión plateau es un indicador de si es seguro continuar cerrando o se requiere reducción por etapas. Es importante, excluir los casos con sepsis grave, lesiones cardíacas o compromiso respiratorio (es decir, aquellos casos con valores iniciales de Plateau superiores a 12 cm H2O en el momento de la inducción de la anestesia), ya que estos pacientes invariablemente tienen lecturas elevadas de presión plateau. En estos pacientes, se debe emplear la medición estándar de la presión intravesical si se considera necesario (9). Se
En las modalidades cicladas por presión con flujo inspiratorio decreciente, la presión pico podría considerarse similar a la presión plateau (10), una Presión inspiratoria máxima o pico mayor de > 30cmH2O indica el requerimiento de una cirugía por estadios (1), sin embargo, la presión plateau es la que cuenta con relevancia acorde a los estudios realizados.
La comunicación entre cirujano y anestesiólogo es
esencial en la reducción del contenido herniado a
la cavidad abdominal pues la elevación de presión
intraabdominal están relacionadas a la restricción del
movimiento diafragmático llegando a causar compromiso
respiratorio, observado por el aumento significativo de las
presiones respiratorias, descenso del volumen tidal y de la
oximetría. Además, la reducción de los órganos a cavidad
abdominal causa compresión de la vena cava inferior
pudiendo llevar a síndrome compartimental abdominal
con presiones mayores de 10-15 cm H2O produciendo
reducción de la perfusión renal resultando en oliguria/
anuria, reducción de perfusión hepática causando daño
hepático, isquemia intestinal desencadenando necrosis y acidosis metabólica, baja perfusión de extremidades con llenado capilar retardado y elevación de la tensión en la piel abdominal. Si la presión intragástrica es mayor de 20 cm H O (9) presión vesical mayor de 15-20 mm Hg (11), ETCO2mayoroiguala50mmHg,PVCmayorde4mmHg 2
o presión plateau mayor de 24 cm H2O (9) se debe realizar reapertura o reducción de tensión en bolsa de silo.
Se ha reportado el uso de pulsioximetria en extremidades como valor para guiar el cierre en gastrosquisis, sin embargo, se ha observado que el cambio en pulsioximetria es posterior al aumento de ETCO2 el cual puede proporcionar una evaluación rápida de la adecuación ventilatoria o de los cambios agudos en la perfusión (1,4,5,12). Hong Et. al reportaron el uso de monitorización continua de oximetría de pulso posductal en sitios proximales y distales al abdomen simultáneamente, al inicio del procedimiento la saturación fue de 95 % en ambos lados, tras la manipulación de los intestinos hacia la cavidad abdominal y el cierre de la pared abdominal, se observó la disminución de la saturación en la extremidad inferior entre un 5-8 %, permaneciendo en la extremidad superior sin cambios, reequilibrándose a los 3-5 minutos al termino del cierre. La monitorización simultánea de la oximetría de pulso proximal y distal al abdomen resulta prometedora con respecto a la detección de
disminuciones en el retorno venoso, disminuciones en la perfusión arterial en las extremidades inferiores y, en última instancia, en la PIA, es en tiempo real, no invasivo y rentable, con utilidad en perioperatorio y postoperatorio (13), aunque se requieren más estudios. En defectos pequeños se puede extubar al final del procedimiento, aunque gran parte requiere ventilación invasiva debido al incremento en la presión intraabdominal que compromete la función respiratoria (1). Con la mejoría y el conocimiento del manejo pre y postoperatorio la mortalidad ha disminuido menor o igual a 5 % (1,2,3).
Conclusión
Nuestro manejo y monitorización anestésica habitual debe estar encaminado a puntos principales como la valoración respiratoria minuciosa, manejo hídrico adecuado, la implementación de técnicas adecuadas para la intubación, la monitorización del ETCCO2, presión plateau, gasto urinario, temperatura, el conocer los valores de corte para establecer la cirugía por estadios y la comunicación con el equipo quirúrgico (Tabla II) son de gran ayuda para guiar el manejo del paciente favoreciendo los resultados de supervivencia.
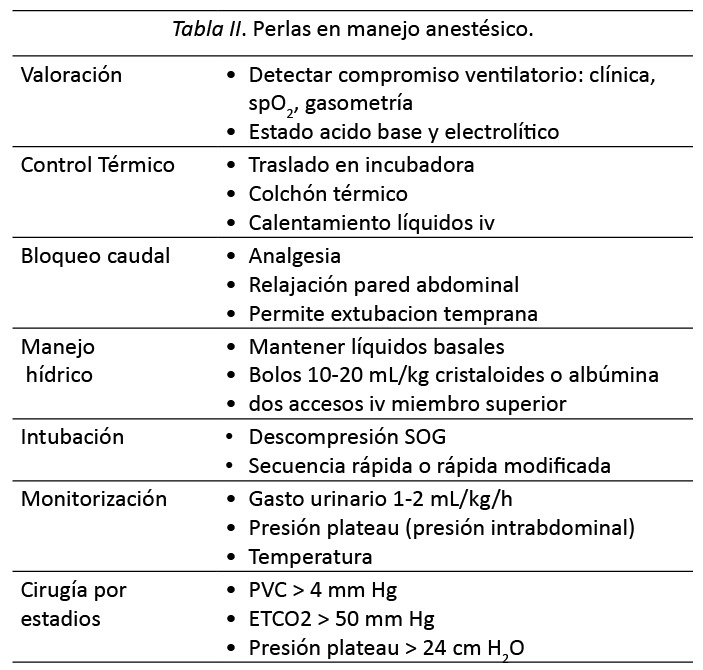
Referencias
1. Poddar R, Hartley L. Exomphalos and gastroschisis, conti- nuing education in Anaesthesia Critical Care and Pain. 2009; 9 (2):48–51. https://doi.org/10.1093/bjaceaccp/mkp001
3. Rentea RM, Gupta V. Gastroschisis. [Updated 2023 Apr 10]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2024 Jan-. Available from: https://www.ncbi. nlm.nih.gov/books/NBK557894/
4. Wouters K, Walker I. Neonatal anaesthesia 2: Anaesthe- sia for neonates with abdominal wall defects. Anaesthesia Tutorial of the week. Paediatric anaesthesia Tutorial 070. 2008; 1-10. Available from: https://resources.wfsahq. org/atotw/neonatal-anaesthesia-2-anaesthesia-for-neo- nates-with-abdominal-wall-defects/
5. Obeida A, Shalaby A. Management of Gastroschisis [Inter- net]. Pediatric Surgery, Flowcharts and Clinical Algorithms. IntechOpen; 2019, 1-168. DOI:10,5772/intechopen.85510.
6. Haddock C, Skarsgard ED. Understanding gastroschisis and its clinical management: where are we? Expert Rev Gastroenterol Hepatol. 2018 Apr;12(4):405-415. doi: 10.1080/17474124.2018.1438890. Epub 2018 Feb 16. PMID: 29419329.
7. Rivera D, Rivas C, Rivera L. Gastrosquisis y anestesia: estado del arte y propuesta de manejo inicial. Artículo de revisión. R.F.S Revista Facultad de Salud, 2020; 12(2): 1-8. Recuper- ado el 22 de 11 de 2023 de https://journalusco.edu.co/in- dex.php/rfs/article/view/3184
8. Kasat N, Dave N, Shah H, Mahajan S. Correção de gastros- quise sob anestesia caudal: uma série de três casos [Gas- troschisis repair under caudal anesthesia: a series of three cases]. Rev Bras Anestesiol. 2017;67(3):326-328. Portu- guese. doi: 10.1016/j.bjan.2016.07.004. Epub 2017 Mar 30. PMID: 28364969.
9. Banieghbal B, Gouws M, Davies MR. Respiratory pressure monitoring as an indirect method of intra-abdominal pres- sure measurement in gastroschisis closure. Eur J Pediatr Surg. 2006;16(2):79-83. doi: 10.1055/s-2006-924051. PMID: 16685611.
10. Pérez M, Mancebo J. Monitorización de la mecánica ventilatoria. Medicina Intensiva, 2006; 30(9): 440-448. ISSN 0210-5691 Recuperado el 10 de febrero de 2024, de http://scielo.isciii.es/scielo.php?script=sci_arttex- t&pid=S0210-56912006000900004&lng=es&tlng=es.
11. OlesevichM,AlexanderF,KhanM,CotmanK.Gastroschisis revisited: role of intraoperative measurement of abdominal pressure. J Pediatr Surg. 2005;40(5):789-92. doi:10.1016/j. jpedsurg.2005.01.043. PMID: 15937815.
12. Puffinbarger NK, Taylor DV, Tuggle DW, Tunell WP. End-tid- al carbon dioxide for monitoring primary closure of gas-
282. doi:10.1016/s0022-3468(96)90016-0
13. Hong C M, Patel A. Novel intra-operative pulse oximetry
monitoring for gastroschisis: a noninvasive monitor of in- tra-abdominal pressure. Pediatric Anesthesia, 2008; 18(4): 344–345. doi:10.1111/j.1460
